Obter acesso ao(s) LCAL2003: Chemistry labs (ultraconcurrent) agora
Por apenas
US$ 9,99Um pagamento
6 meses de acesso
Métodos de pagamento suportados:
- DigiKey (Não disponível em todos os países)
- Cartão de crédito ou débito
- PayPal
Você precisa criar ou usar uma conta da LabsLand para continuar.
Incluído o acesso remoto a 12 laboratórios:
Tentando comprar múltiplas licenças para uma turma? Entre em contato conosco para descontos em volume
O que é a Labsland
A Labsland é uma rede mundial de laboratórios remotos.
Os equipamentos são sempre reais, não uma simulação.
Você controla o equipamento real podendo vê-los por webcams pela Internet.
Acesse agora. Não é necessário aguardar para comprar um equipamento.
Sem custos ocultos: tudo incluído. Sem acessórios ou custos de envio.
Muito fácil de usar: o equipamento já está funcionando.
Alugue apenas nos meses necessários para o seu aprendizado
Como a LabsLand funciona?
A LabsLand é uma rede global de laboratórios reais disponíveis online. Os alunos (em escolas, universidades e plataformas de aprendizado em sua casa) podem acessar laboratórios reais pela Internet, usando seu notebook,tablet ou celular.
Os laboratórios são em tempo real (Arduino, FPGAs ...) localizados em diferentes universidades em todo o mundo. Em certos campos (Física, Biologia, Química) os laboratórios são chamados Laboratórios Ultraconcorrentes, neste caso, a universidade registrou todas as combinações potenciais do que pode ser feito em laboratório (em alguns casos, milhares) e disponibilizou-as de forma interativa.
Em todos os casos, o laboratório é sempre real (não simulado) e está disponível na Web (você não precisa obter nenhum hardware, aguardar encomendas, etc.).
Verifique no seguinte vídeo como uma sessão de usuário funciona :
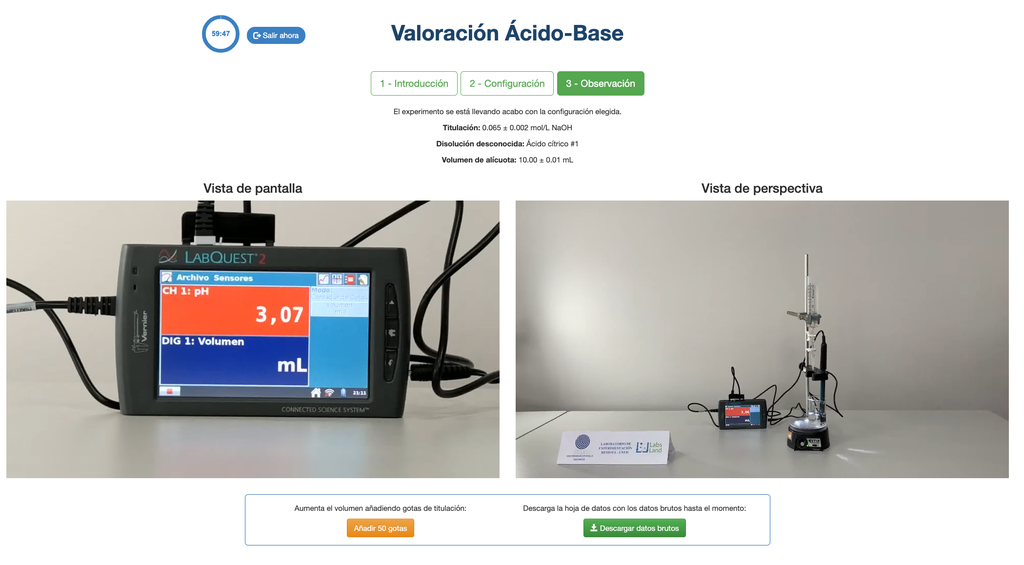
Ácido-Base II
Resumo
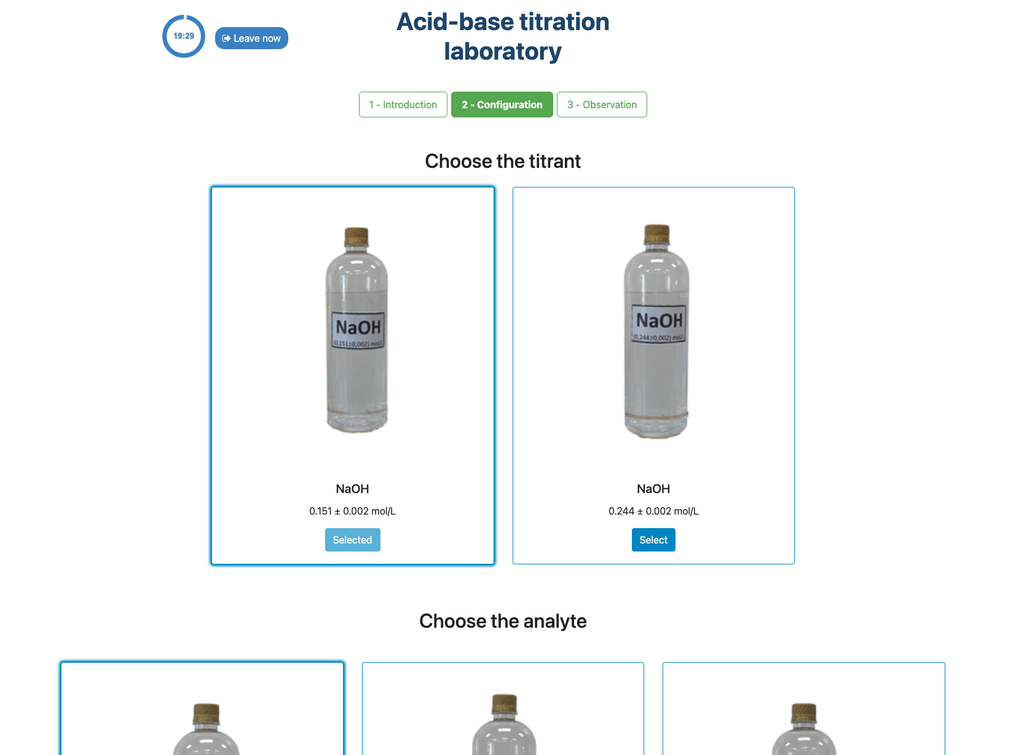
Realize uma titulação ácido-base para determinar a concentração de uma solução desconhecida de ácido acético utilizando um titulante de hidróxido de sódio. Este laboratório enfatiza medições visuais lidando com o menisco da bureta, e suporta duas configurações diferentes.
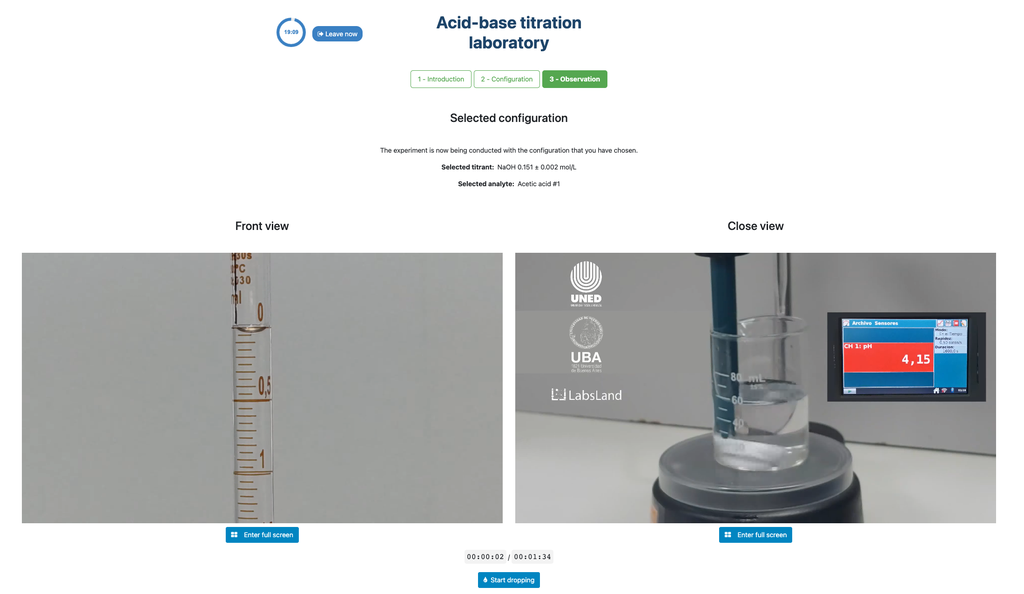
A primeira é para uma abordagem potenciométrica: você terá acesso a um sensor de pH digital e poderá utilizá-lo para determinar quando a solução desconhecida foi neutralizada.
A segunda é para uma abordagem colorimétrica: você pode confiar na mudança de cor devido à presença de um indicador de fenolftaleína, sem ter um sensor de pH digital disponível.
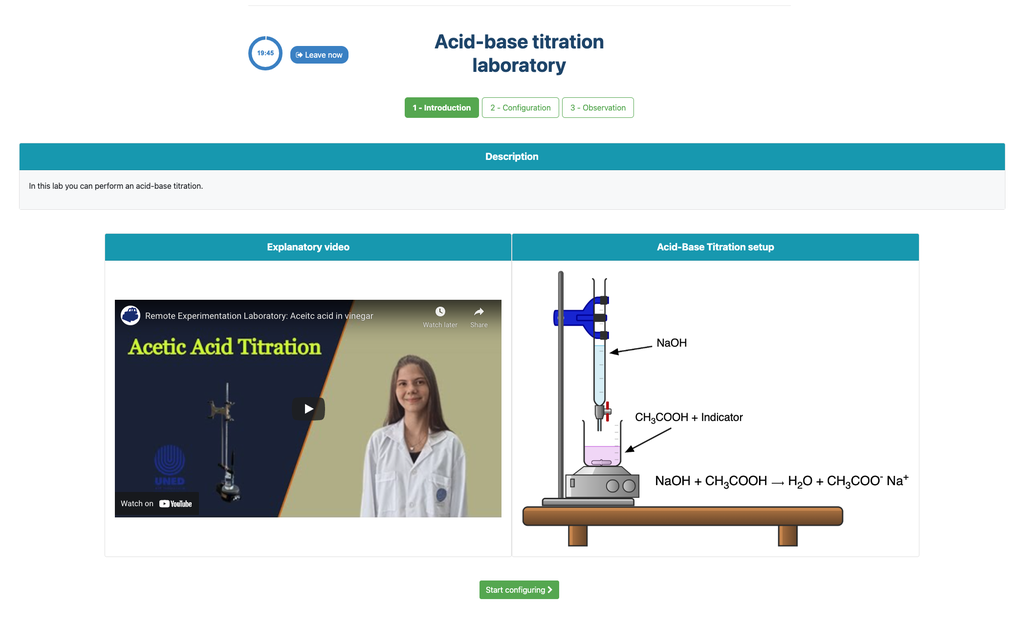
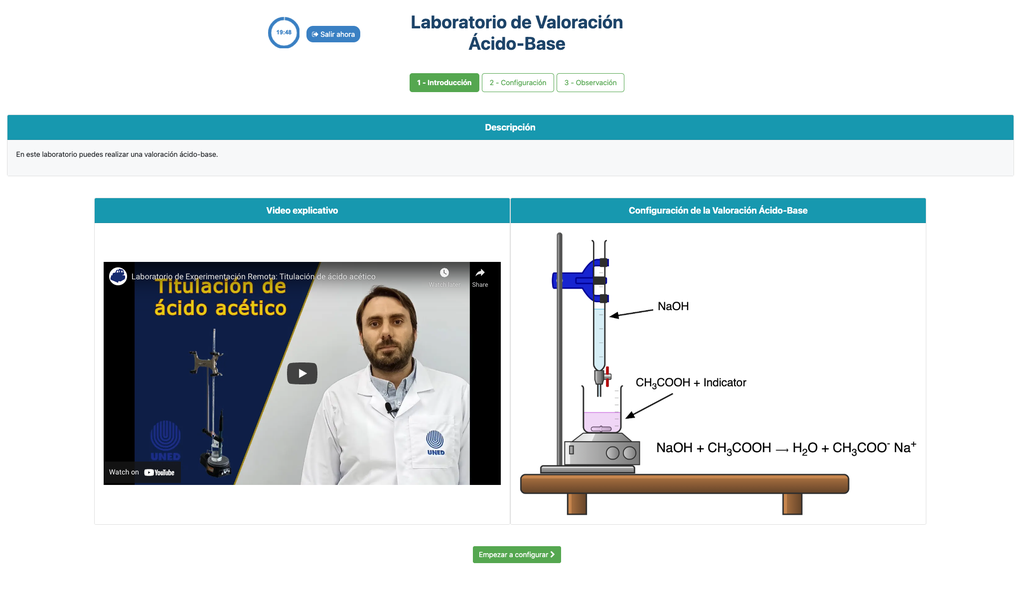
Titulação Ácido-Base
As titulações são um método volumétrico baseado na medição da quantidade de um reativo de concentração conhecida (conhecido como padrão primário) que é consumido por uma amostra de concentração desconhecida conhecida como analito.
A titulação é conduzida adicionando o titulante ao analito utilizando uma bureta, de modo a obter uma substância quimicamente equivalente entre o titulante e o analito. Isso é conhecido como o "ponto de equivalência" e é um valor teórico que não pode ser determinado experimentalmente.
A estimativa experimental deste ponto é obtida através de uma aproximação conhecida como "ponto final". Isso é determinado através de uma mudança física. Nesse caso, a mudança de cor da solução é conseguida após a adição de uma substância indicadora: uma substância que muda de cor em certos intervalos de pH.
Para a titulação ácido-base usamos um indicador de fenolftaleína que fica rosa claro após um pH de cerca de 8,4, que é um valor muito próximo ao ponto de equivalência nas titulações ácido-base mais comuns.
Alternativamente, na configuração potenciométrica, um sensor de pH digital pode ser usado para determinar o "ponto de equivalência".
Abordagem Colorimétrica vs Potenciométrica
A abordagem colorimétrica se baseia na mudança de cor proporcionada pelo indicador de fenolftaleína. A abordagem potenciométrica, por outro lado, se baseia na elevação do pH conforme medido pelo sensor digital. Nesta versão do laboratório, existem duas configurações diferentes disponíveis, uma para cada abordagem. Na configuração colorimétrica, os alunos podem não ver o sensor de pH digital.
Diferenças com o laboratório de Titulação Ácido-Base II
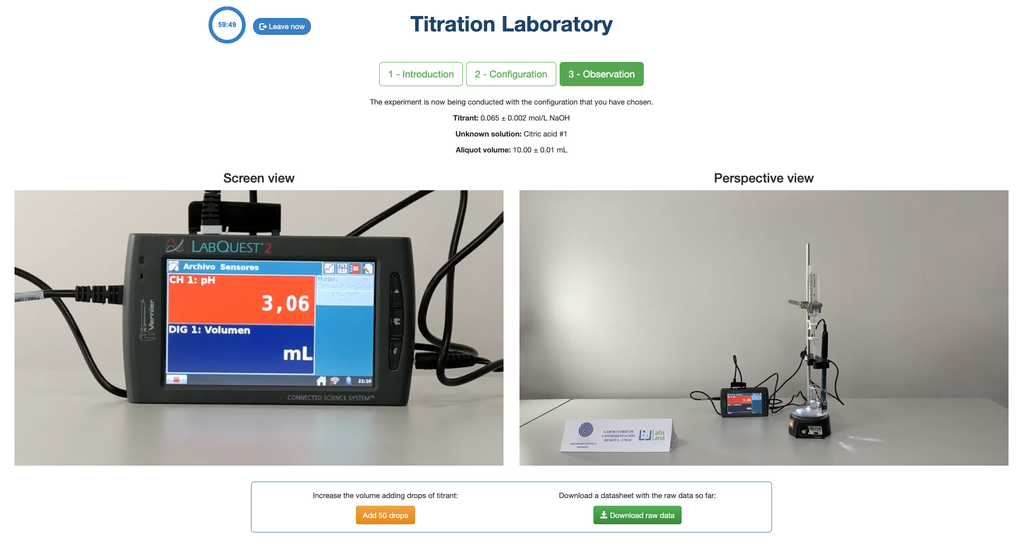
Nesta versão do laboratório (Titulação Ácido-Base II), você pode realizar a titulação ácido-base para uma solução desconhecida de ácido acético. Na outra versão do laboratório (veja Titulação Ácido-Base I), você pode realizar a titulação ácido-base para uma solução de ácido cítrico em vez disso.
Esta versão do laboratório enfatiza as medições visuais da bureta, incluindo a leitura adequada do menisco na bureta. A outra versão do laboratório (veja Titulação Ácido-Base I) não enfatiza isso, e foca nos cálculos em vez disso.
Além disso, nesta versão você pode escolher entre duas configurações diferentes: uma para a abordagem potenciométrica e uma para a abordagem colorimétrica. A configuração para a abordagem colorimétrica não mostra o sensor de pH. Na outra versão do laboratório (veja Titulação Ácido-Base I) há uma única configuração e o sensor é sempre mostrado.
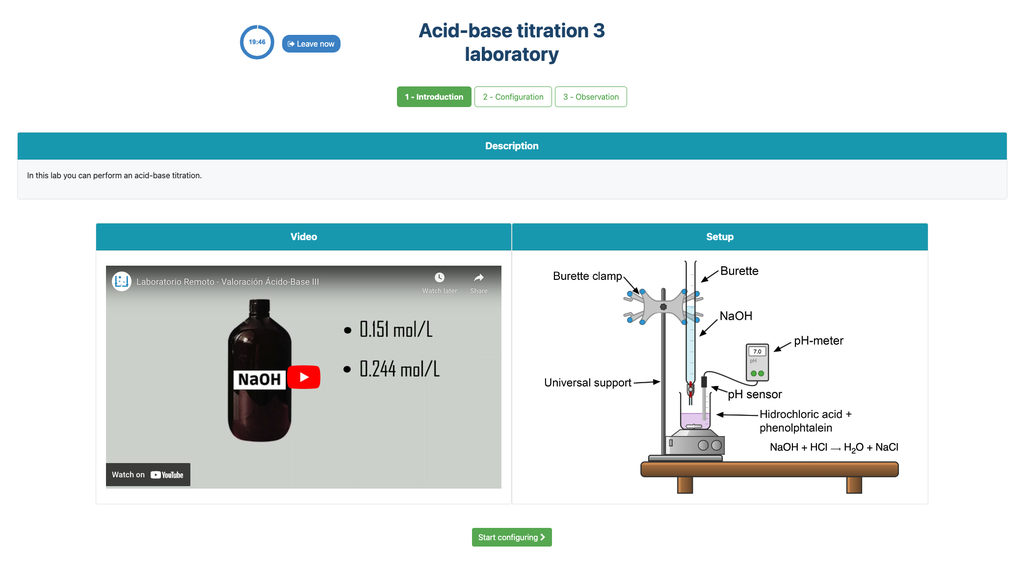
Titulação Ácido-Base III
Resumo
Realize uma titulação ácido-base para determinar a concentração de uma solução desconhecida de ácido clorídrico usando um titulante de hidróxido de sódio. Este laboratório enfatiza medições visuais lidando com o menisco da bureta, e suporta duas configurações diferentes.
A primeira é para uma abordagem potenciométrica: você terá acesso a um sensor de pH digital e pode usá-lo para determinar quando a solução desconhecida foi neutralizada.
A segunda é para uma abordagem colorimétrica: você pode confiar na mudança de cor devido à presença de um indicador de fenolftaleína, sem ter disponível um sensor de pH digital.
Titulação ácido-base
Titulações são um método volumétrico que se baseia na medição da quantidade de um reagente de concentração conhecida (conhecido como padrão primário) que é consumido por uma amostra de concentração desconhecida conhecida como analito.
A titulação é conduzida adicionando-se o titulante ao analito usando uma bureta, de modo a obter uma substância quimicamente equivalente entre o titulante e o analito. Isso é conhecido como o "ponto de equivalência" e é um valor teórico que não pode ser determinado experimentalmente.
A estimativa experimental deste ponto é obtida através de uma aproximação conhecida como "ponto final". Isso é determinado através de uma mudança física. Nesse caso, a mudança de cor da solução é alcançada após a adição de uma substância indicadora: uma substância que muda de cor em certos intervalos de pH.
Para a titulação ácido-base usamos um indicador de fenolftaleína que se torna rosa claro após um pH de cerca de 8,4, que é um valor muito próximo ao ponto de equivalência nas titulações ácido-base mais comuns.
Alternativamente, na configuração potenciométrica, um sensor de pH digital pode ser usado para determinar o "ponto de equivalência".
Abordagem Colorimétrica vs Potenciométrica
A abordagem colorimétrica se baseia na mudança de cor fornecida pelo indicador de fenolftaleína. A abordagem potenciométrica, por sua vez, baseia-se no aumento do pH medido pelo sensor digital. Nesta versão do laboratório estão disponíveis duas configurações diferentes, uma para cada abordagem. Na configuração colorimétrica os alunos podem não ver o sensor de pH digital.
Diferenças com outros laboratórios de titulação
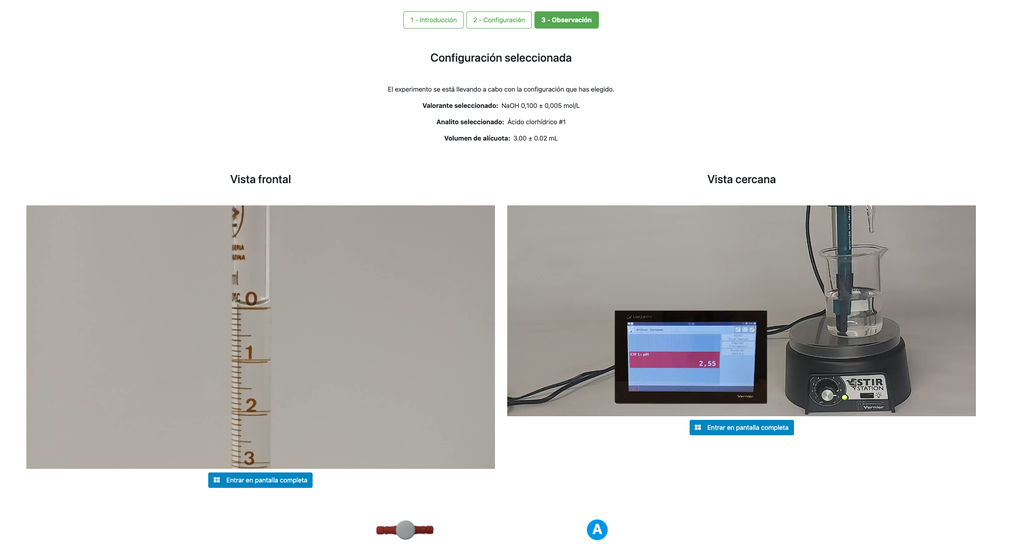
Nesta versão do laboratório (Titulação Ácido-Base II) você pode realizar a titulação ácido-base para uma solução desconhecida de ácido clorídrico. Em outras versões do laboratório você pode realizar a titulação ácido-base para uma solução de ácido cítrico (Titulação Ácido-Base I), e ácido acético (Titulação Ácido-Base II).
Tanto esta versão do laboratório (Titulação Ácido-Base III) quanto a Titulação Ácido-Base II enfatizam medições visuais com a bureta, incluindo a leitura correta do menisco na bureta. A outra versão do laboratório (ver Titulação Ácido-Base I) não enfatiza isso, e foca nos cálculos em vez disso.
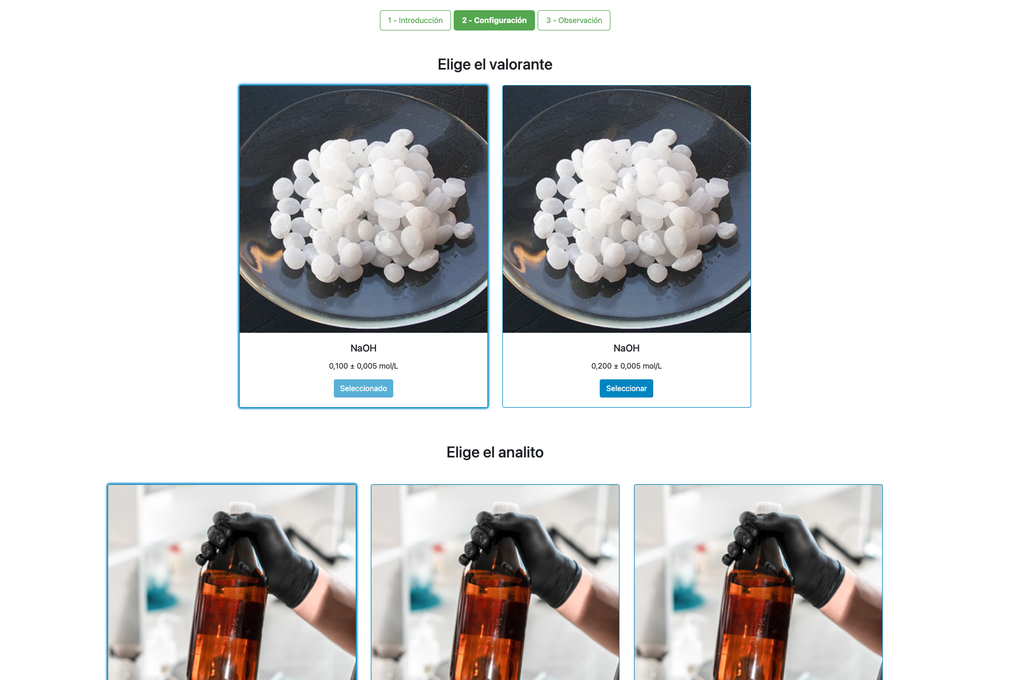
Além disso, nessas versões você pode escolher entre duas configurações diferentes: uma para a abordagem potenciométrica e outra para a abordagem colorimétrica. A configuração para a abordagem colorimétrica não mostra o sensor de pH. Na outra versão do laboratório (ver Titulação Ácido-Base I) há uma única configuração e o sensor é sempre mostrado.

Titulação Ácido-Base I
Resumo
Realize uma titulação ácido-base para determinar a concentração de uma solução desconhecida de ácido cítrico usando um titulante de hidróxido de sódio. Um sensor de pH digital está sempre disponível e um indicador de fenolftaleína foi aplicado à solução desconhecida, de modo que tanto uma abordagem potenciométrica quanto colorimétrica podem ser usadas. Um gráfico em tempo real também está disponível.
Titulação Ácido-Base
As titulações são um método volumétrico que se baseia na medição da quantidade de um reagente de concentração conhecida (conhecido como padrão primário) que é consumido por uma amostra de concentração desconhecida conhecida como analito.
A titulação é conduzida adicionando o titulante ao analito usando uma bureta, de modo a obter uma substância quimicamente equivalente entre o titulante e o analito. Isso é conhecido como "ponto de equivalência" e é um valor teórico que não pode ser determinado experimentalmente.
A estimativa experimental desse ponto é obtida através de uma aproximação conhecida como "ponto final". Isso é determinado por meio de uma mudança física. Nesse caso, a mudança de cor da solução é obtida após a adição de uma substância indicadora: uma substância que muda de cor em determinados intervalos de pH.
Para a titulação ácido-base, usamos um indicador de fenolftaleína que se torna rosa claro após um pH de cerca de 8,4, que é um valor muito próximo ao ponto de equivalência nas titulações ácido-base mais comuns.
Abordagens Colorimétrica vs Potenciométrica
A abordagem colorimétrica depende da mudança de cor fornecida pelo indicador de fenolftaleína. A abordagem potenciométrica depende, em vez disso, do aumento do pH medido pelo sensor digital. Nesta versão do laboratório de titulação ácido-base, ambas as abordagens podem ser usadas. O sensor digital está sempre disponível e não pode ser ocultado.
Diferenças com o Laboratório de Titulação Ácido-Base II
Nesta versão do laboratório (Titulação Ácido-Base I) você pode realizar a titulação ácido-base para uma solução desconhecida de ácido cítrico. Na outra versão do laboratório (veja Titulação Ácido-Base II) você pode realizar a titulação ácido-base para uma solução de ácido acético.
Esta versão do laboratório enfatiza os cálculos, mas não tem medições visuais de bureta entre seus objetivos de aprendizagem. A outra versão do laboratório (veja Titulação Ácido-Base II) enfatiza medições visuais, e os alunos devem aprender a ler corretamente o menisco da bureta.
Além disso, nesta versão há uma única experiência que pode ser usada para ambas as abordagens colorimétrica e potenciométrica. Na outra versão do laboratório (veja Titulação Ácido-Base II) há duas configurações diferentes disponíveis, em uma das quais o sensor digital é ocultado para que os alunos possam depender apenas da mudança de cor.
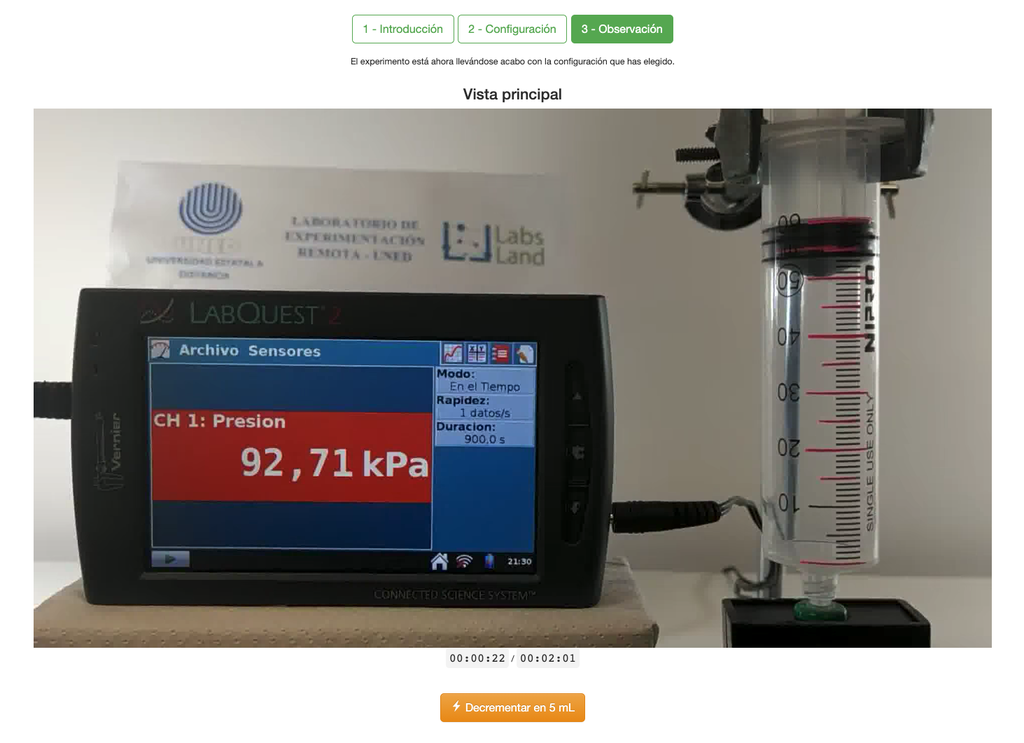
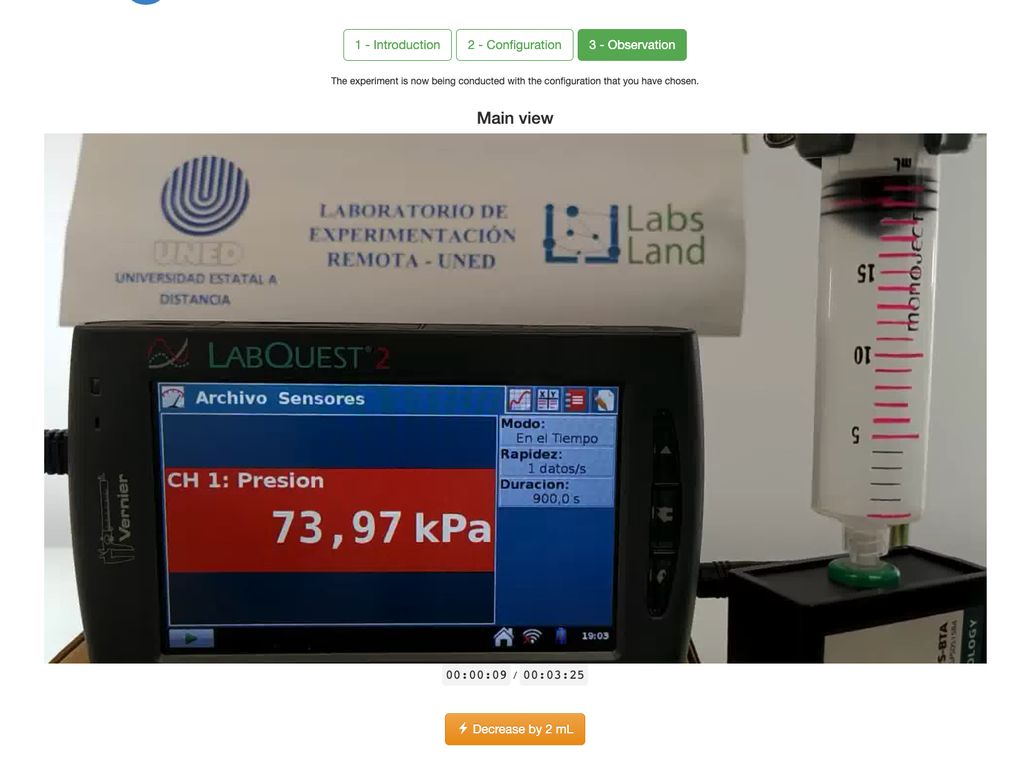
Lei de Boyle
Resumo
O laboratório da Lei de Boyle permite que os alunos determinem a relação entre a pressão e o volume de um gás em temperatura ambiente e constante. Os alunos podem escolher entre duas seringas de volume diferente e medir a pressão do gás à medida que reduzem o volume. O experimento é refletido em uma análise gráfica na forma de uma isotérmica. Dessa forma, eles podem verificar a Lei de Boyle e aprender sobre o comportamento dos gases de maneira prática e acessível.
Lei de Boyle
A Lei de Boyle estabelece que, a temperatura constante, o volume de um gás é inversamente proporcional à sua pressão. Isso significa que quando a pressão de um gás aumenta, seu volume diminui e vice-versa. A Lei de Boyle pode ser expressa matematicamente como:
V ∝ 1/P
Onde V é o volume do gás e P é a pressão do gás.
O laboratório da Lei de Boyle permite que os alunos ponham essa lei em prática e a verifiquem em um contexto experimental. Medindo o volume e a pressão do gás em diferentes momentos, eles podem traçar um gráfico isotérmico que mostra como o volume do gás muda com base em sua pressão. Se o gráfico isotérmico se ajustar à Lei de Boyle, então os alunos verificaram experimentalmente a lei.
Realizar experimentos como este é uma excelente maneira de aprender sobre o comportamento dos gases e como diferentes variáveis estão relacionadas. Além disso, experimentos práticos podem ser mais acessíveis e memoráveis para os alunos do que simplesmente ler sobre a lei em um livro didático. O gráfico isotérmico visualiza claramente o comportamento do gás e verifica se as previsões da Lei de Boyle são atendidas.
Aplicação no Ensino Secundário e Universitário
O laboratório da Lei de Boyle é tipicamente aplicado em cursos de ciências no nível do ensino médio e em cursos de química no nível universitário. No ensino médio, o laboratório pode ser aplicado em um curso de ciências onde os conceitos básicos de química e física, como a pressão e o volume dos gases, são estudados. Na universidade, o laboratório da Lei de Boyle pode ser aplicado em um curso de química mais avançado, onde o estudo dos gases e seu comportamento é aprofundado.
Objetivos
Um laboratório da Lei de Boyle pode ter diferentes objetivos educacionais dependendo do nível educacional em que é aplicado. Aqui estão alguns exemplos de objetivos que um laboratório da Lei de Boyle pode ter tanto no nível do ensino médio quanto no nível universitário:
No nível do ensino médio:
- Os alunos entendem a Lei de Boyle e sua importância na física dos gases.
- Os alunos praticam habilidades experimentais e observacionais.
- Os alunos desenvolvem habilidades de análise e representação de dados.
- Os alunos compreendem a relação entre temperatura, pressão e volume dos gases.
No nível universitário:
- Os alunos conhecem a Lei de Boyle e sua importância na física dos gases.
- Os alunos demonstram habilidades experimentais e observacionais no laboratório.
- Os alunos aplicam conceitos teóricos de física dos gases em situações práticas.
- Os alunos desenvolvem habilidades de análise e representação de dados em um contexto científico.
- Os alunos entendem como temperatura, pressão e volume dos gases se relacionam em diferentes situações.
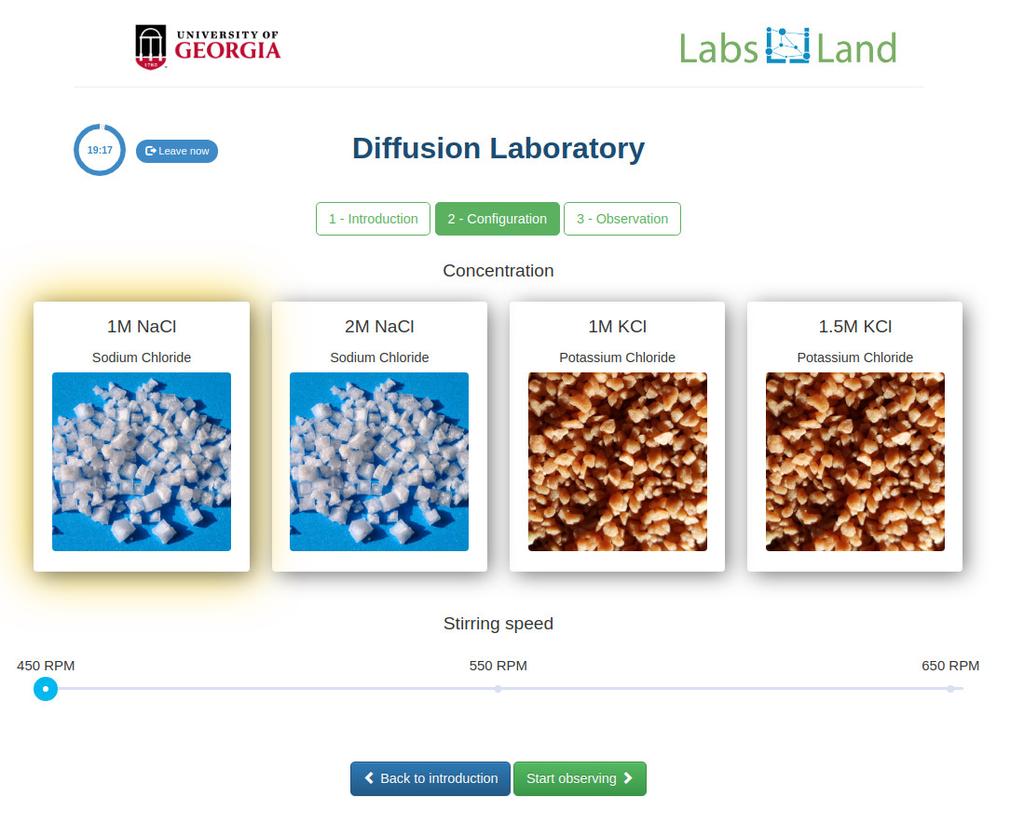
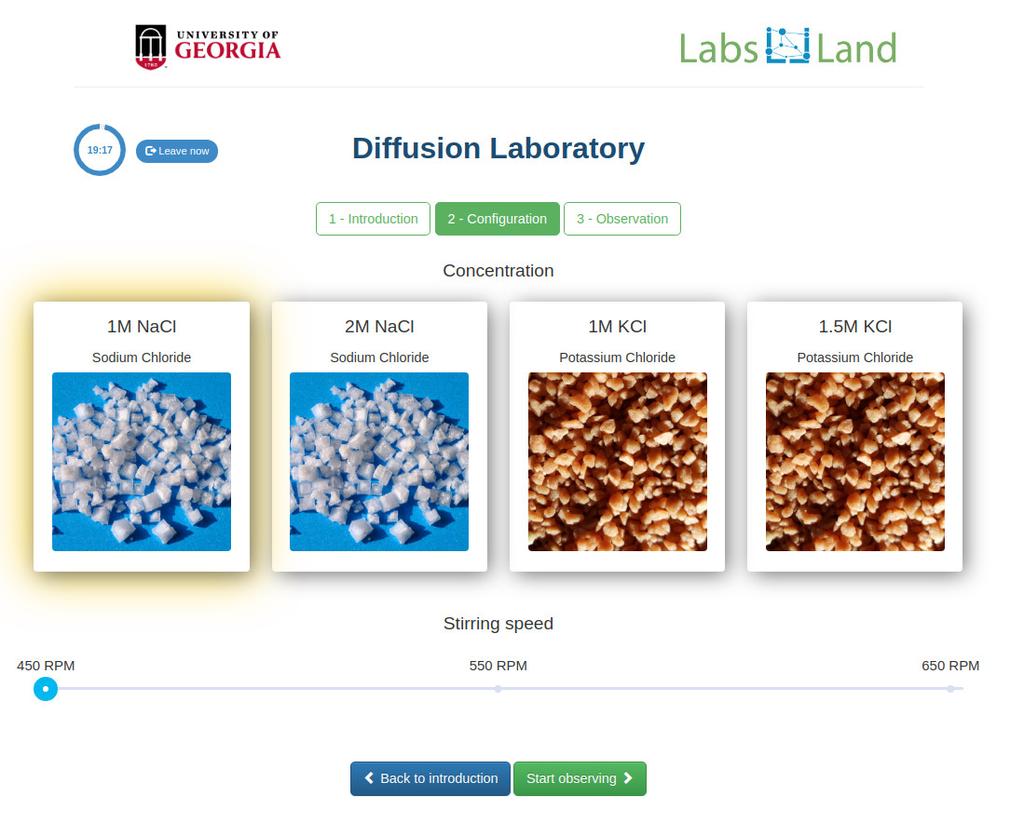
Diffusion laboratory - basic
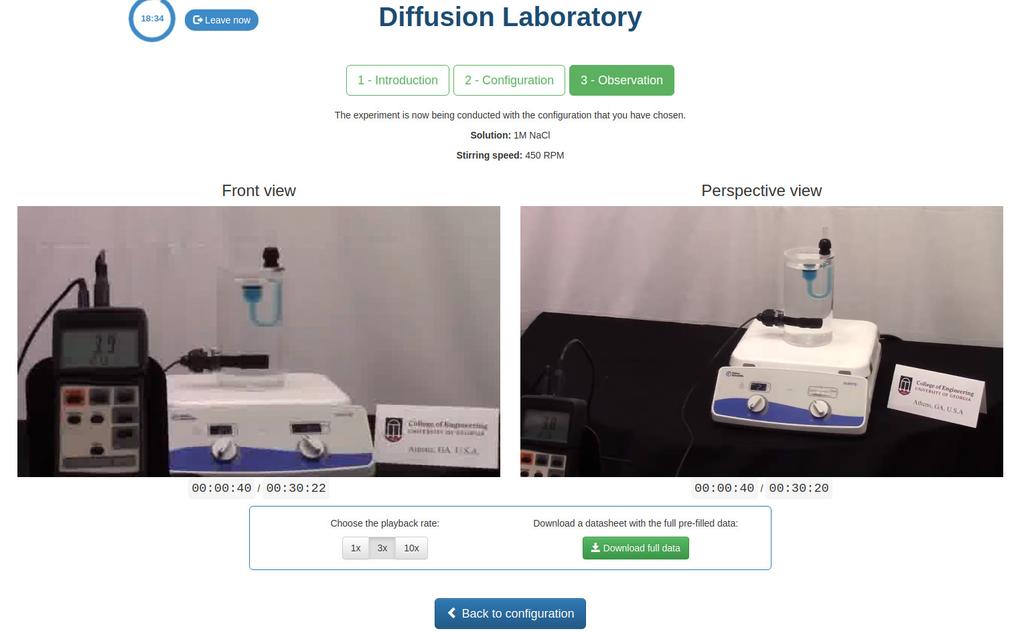
Diffusion laboratory - data
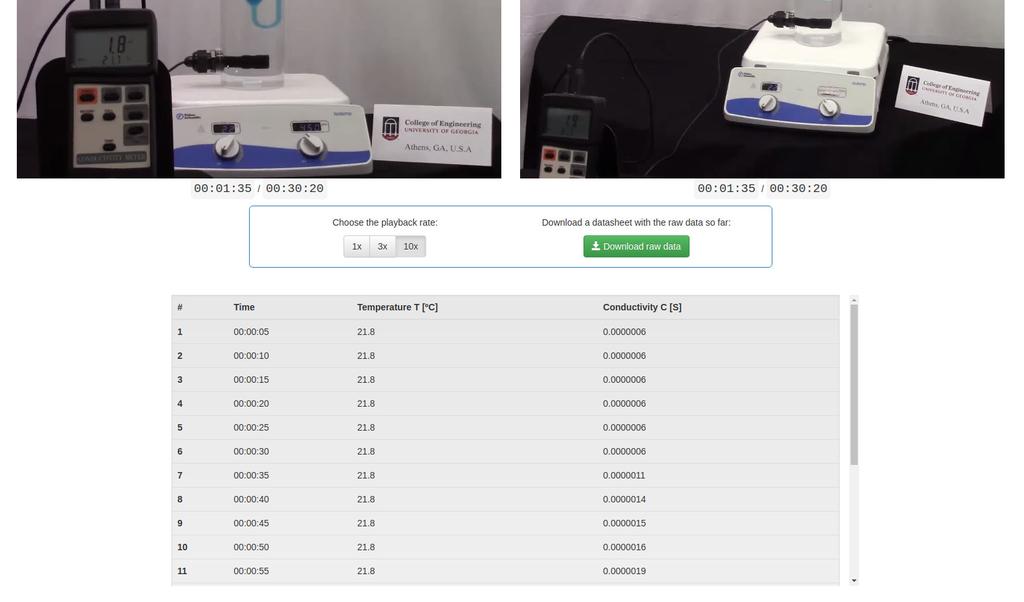
Diffusion laboratory - full
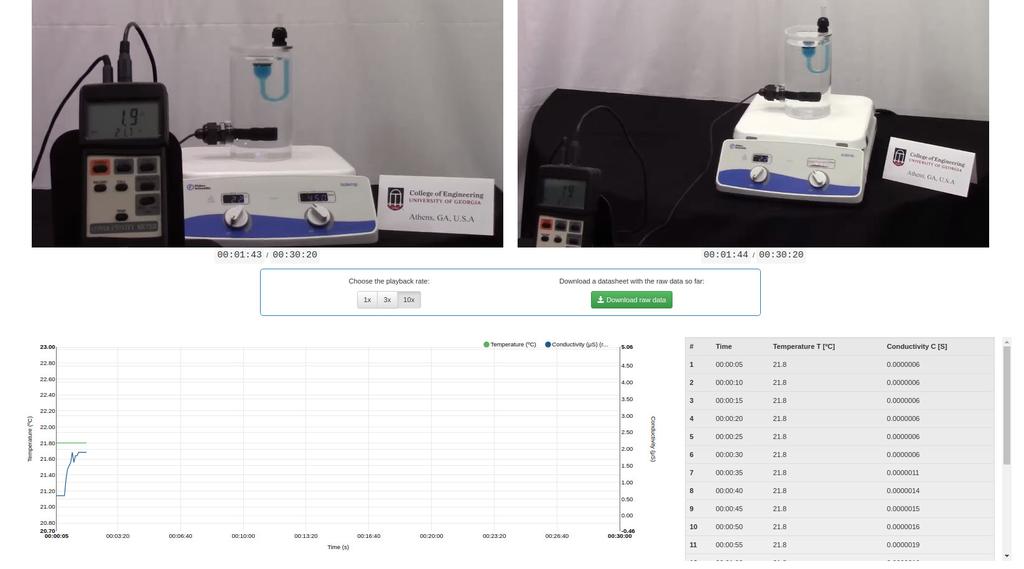
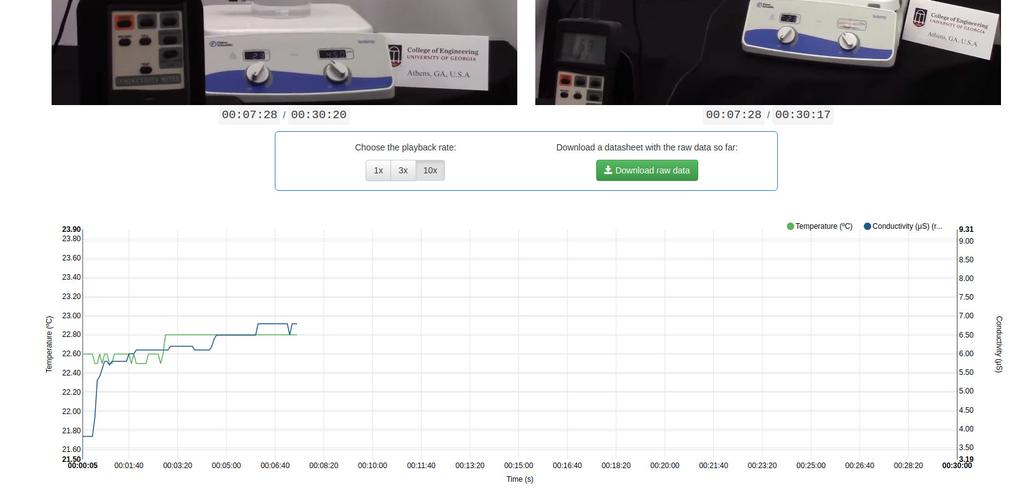
Diffusion laboratory - plot
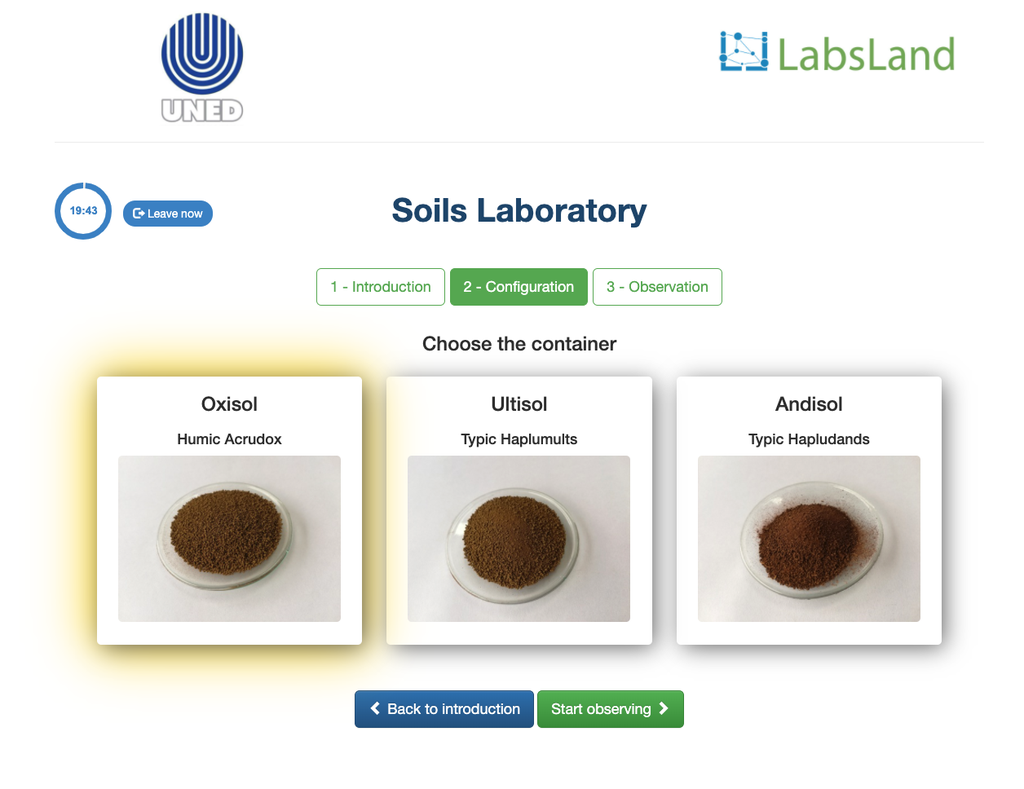
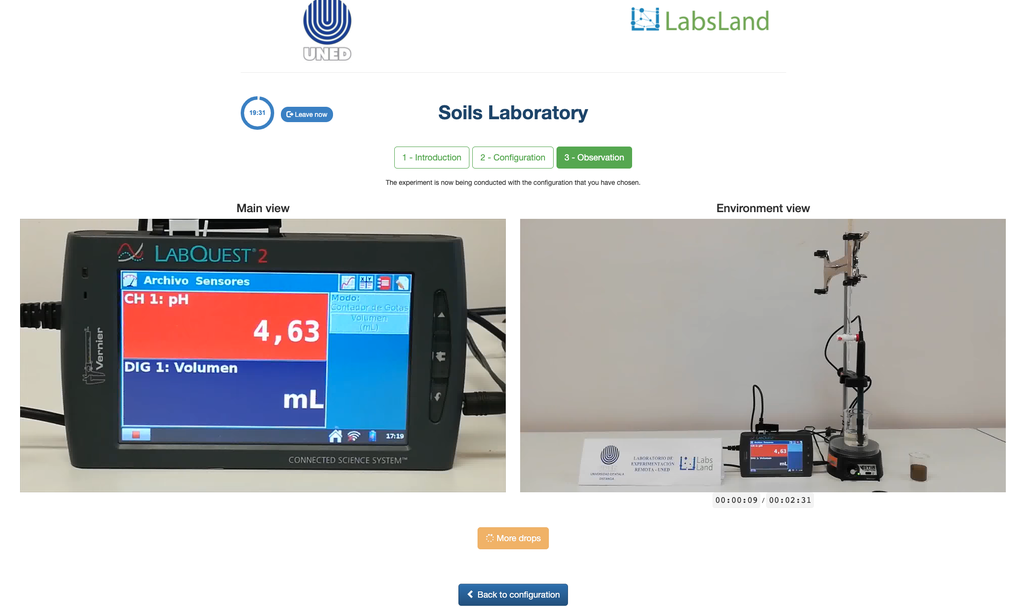
Acidez Trocável dos Solos
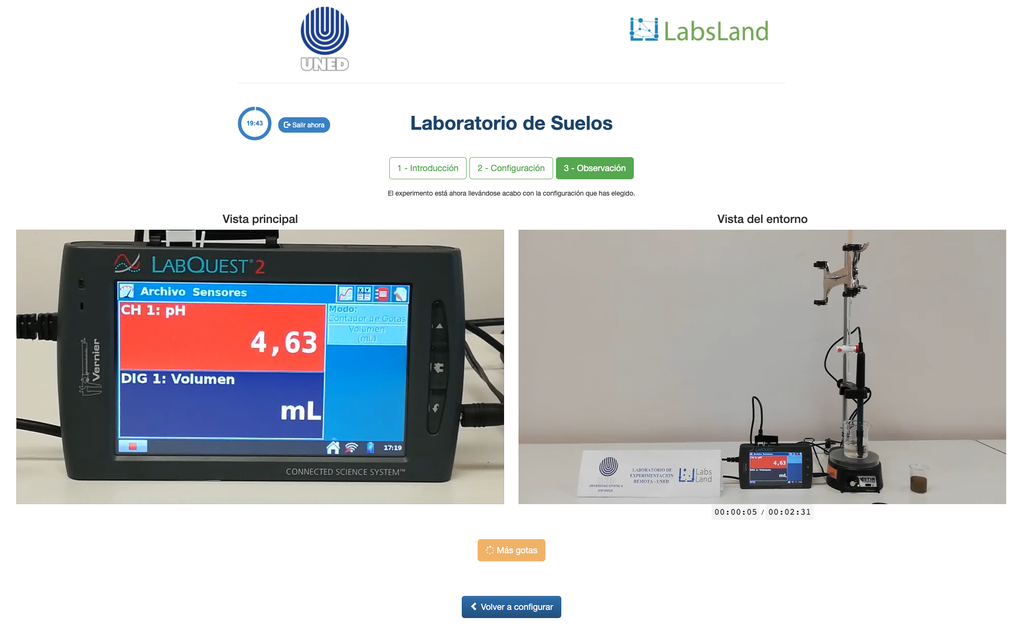
A acidez dos solos pode ocorrer devido a vários processos que promovem uma redução do pH. Esses processos ocorrem naturalmente ou por ação humana. As principais fontes de acidez do solo estão associadas aos íons de hidrogênio (H+) e aos íons de alumínio (Al+3) na solução do solo. A acidez trocável é determinada através do uso de soluções de sais neutros, como o cloreto de potássio (KCl). Os íons ácidos (alumínio e hidrônio) que estão retidos na fração coloidal do solo, que na presença de um íon deslocador (K+), fazem com que esses entrem na solução do solo. Após isso, essa solução é titulada com uma solução de hidróxido de sódio de concentração exata para alcançar o ponto final da reação de neutralização usando fenolftaleína como indicador.

Lei de Gay-Lussac
A lei de Gay-Lussac nos permite estudar o comportamento dos gases e é frequentemente estudada em física e química. Ela relaciona a pressão de um gás com sua temperatura, enquanto outros parâmetros, como volume e quantidade, permanecem constantes.
Existem várias maneiras de verificar a lei de Gay-Lussac. Neste experimento, verificaremos que, para uma determinada quantidade de gás, a pressão é diretamente proporcional à temperatura.
Radioatividade
Resumo
O conjunto, útil para escolas e universidades, inclui um contador Geiger que pode medir o número de colisões de partículas detectadas. O usuário pode escolher entre diferentes fontes radioativas, bem como um absorvedor para colocar entre a fonte radioativa e a sonda. Além disso, outros parâmetros que os usuários podem variar são a distância e o número de testes. Isso permite uma ampla gama de experimentos e oportunidades de aprendizado.
Radioatividade
A radioatividade é o processo pelo qual um núcleo atômico perde energia emitindo partículas e radiação. Isso pode ocorrer naturalmente em certos elementos ou artificialmente através do uso de reações nucleares. No contexto da física em escolas e universidades, estudar a radioatividade pode fornecer insights valiosos sobre a natureza fundamental da matéria e as leis da física.
Um experimento comum nesta área é a medição da radioatividade usando um contador Geiger. Este instrumento é capaz de detectar a emissão de partículas de uma fonte radioativa, permitindo aos alunos entender os princípios básicos da radiação e seus efeitos sobre a matéria. Ao variar o tipo de fonte radioativa, a distância entre a fonte e o detector, e o tipo de material absorvedor colocado entre os dois, os alunos podem explorar uma ampla gama de fenômenos e obter uma compreensão mais profunda dos princípios subjacentes.
Além do seu valor educacional, estudar a radioatividade também tem aplicações práticas em áreas como medicina, produção de energia e proteção ambiental. Como tal, é um tópico importante para os alunos aprenderem, tanto pelo seu interesse intrínseco quanto pelas muitas aplicações do mundo real que possui.
Aplicações da radioatividade no mundo real
Uma das aplicações mais comuns da radioatividade é na área da medicina. Isótopos radioativos são usados em técnicas de imagem médica como tomografias PET e SPECT, que permitem aos médicos ver o interior do corpo e diagnosticar doenças. Isótopos radioativos também são usados em tratamentos contra o câncer, como a radioterapia, onde são utilizados para matar células cancerígenas.
A radioatividade também é usada em indústrias como a exploração de petróleo e gás, onde é usada para medir a permeabilidade das formações rochosas e o fluxo de fluidos através delas. Isótopos radioativos também são usados em detectores de fumaça e na produção de relógios e instrumentos luminosos.
No geral, a radioatividade tem uma ampla gama de aplicações em áreas como medicina, indústria e até mesmo em produtos de consumo cotidiano. Continua a ser uma área de estudo importante na física e outras ciências, e suas utilizações continuam a se expandir à medida que novas tecnologias são desenvolvidas.
Experimentos de radioatividade em escolas e universidades
O uso de um contador Geiger em um experimento de radioatividade permite uma ampla gama de possibilidades. Ao variar os emissores e absorvedores de radiação, os alunos podem observar os efeitos de diferentes fontes e materiais nas colisões de partículas detectadas. Isso pode ajudar os alunos a entender as propriedades da radioatividade e o comportamento de diferentes partículas.
Além disso, podem ser realizados experimentos envolvendo a determinação do tipo de partícula emitida observando se a partícula é absorvida ou não. Colocando diferentes absorvedores entre a fonte e a sonda, os alunos podem determinar as propriedades das partículas emitidas e obter uma compreensão mais profunda da radioatividade.
Por fim, podem ser realizados experimentos envolvendo a determinação da forma geométrica da emissão de radioatividade usando um contador Geiger. Medindo cuidadosamente as colisões de partículas detectadas a diferentes distâncias, os alunos podem obter insights sobre a distribuição espacial da radioatividade. Isso pode ajudar os alunos a entender os princípios fundamentais da radioatividade e suas aplicações no mundo real.
Objetivos de aprendizagem potenciais
Os objetivos potenciais das atividades realizadas com o laboratório são os seguintes:
- Compreender as propriedades e o comportamento das emissões radioativas.
- Realizar experimentos para medir os efeitos da radiação em vários materiais.
- Determinar o tipo de radiação emitida por uma fonte radioativa.
- Entender os princípios de segurança e manuseio da radiação.
- Investigar as aplicações da radioatividade em áreas como medicina, indústria e pesquisa.
- Entender os princípios de contadores Geiger e seu uso na medição de radioatividade.
- Compreender o desenvolvimento histórico do conceito de radioatividade e sua descoberta.
- Explorar as implicações éticas do uso de materiais radioativos.

Espectroscopia
Este laboratório ultraconcorrente é baseado em uma prática experimental sobre espectroscopia de raios X usando um dispositivo da marca LEYBOLD que está instalado em um laboratório de instrumentação radiológica na Universidade Nacional da Costa Rica (Universidad Nacional de Costa Rica), localizado no prédio de Física Médica Aplicada.
A montagem consiste em um tubo de raios X com um ânodo de ouro (Au), juntamente com um detector de cintilação configurado com um pré-amplificador e um digitalizador que permite processar informações das medições feitas pelo detector através de software.
O teste visa caracterizar o feixe da fonte de radiação através do cálculo experimental do espectro do feixe de raios X produzido no tubo, além de gerar noções básicas sobre instrumentação radiológica e como a variação de seus parâmetros é usada em aplicações industriais e médicas.











