Ottieni accesso ora a LCAL2003: Chemistry labs (ultraconcurrent)
Per solo:
9,99 USDUn pagamento
6 mesi di accesso
Metodi di pagamento supportati:
- DigiKey (Non disponibile in ogni paese)
- Carta di credito o di debito
- PayPal
Devi creare o usare un account LabsLand per continuare.
Accesso remoto a 12 laboratori incluso:
Stai cercando di acquistare più licenze per una classe? Contattaci per sconti su quantità
Cos'è LabsLand?
LabsLand è la rete globale di laboratori remoti.
Le attrezzature sono sempre reali, non una simulazione.
Controlli le attrezzature reali con le webcam attraverso Internet.
Accedi ora. Non è necessario aspettare che l'attrezzatura venga spedita.
Nessun costo nascosto: tutto incluso. Nessun costo di accessori o di spedizione.
Molto facile da usare: l'attrezzatura è già funzionante.
Noleggialo solo i mesi che ti servono per il tuo apprendimento.
Come funziona LabsLand?
LabsLand è una rete globale di laboratori reali disponibili online. Gli studenti (nelle scuole, università e piattaforme di apprendimento continuo) possono accedere ai laboratori reali tramite Internet, utilizzando il loro laptop, tablet o telefono.
I laboratori sono in tempo reale (Arduino, FPGA...) situati in diverse università in tutto il mondo. In alcuni settori (Fisica, Biologia, Chimica) i laboratori sono LabsLand Ultraconcurrent Laboratories, quindi l'università ha registrato tutte le potenziali combinazioni di ciò che può essere fatto nel laboratorio (in alcuni casi, diverse migliaia) e le rende disponibili in modo interattivo.
In ogni caso, il laboratorio è sempre reale (non simulato), e disponibile tramite il Web (non è necessario ottenere alcun hardware, occuparsi della spedizione, ecc.).
Scopri come funziona una tipica sessione utente nel seguente video:
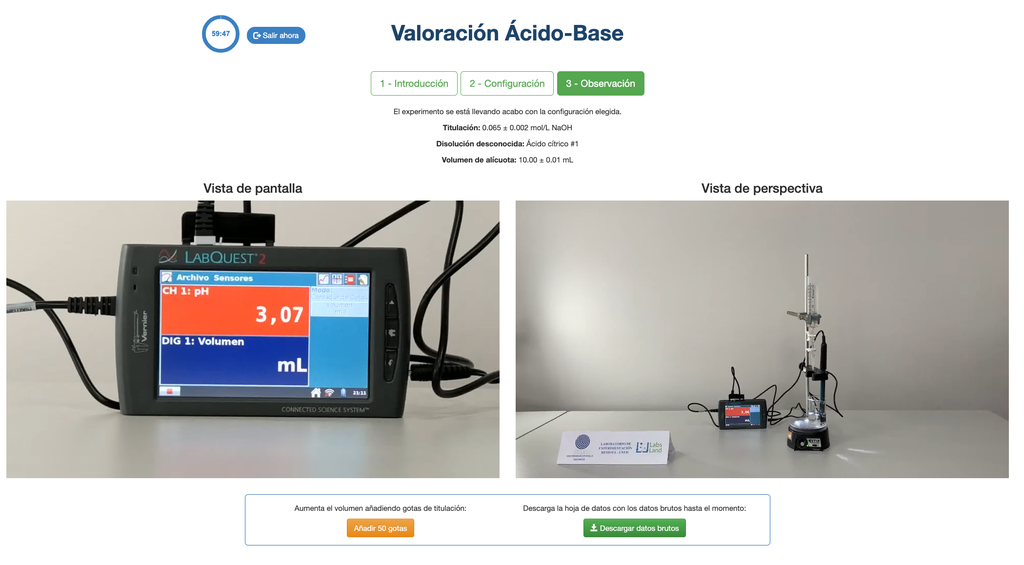
Titolazione Acido-Base II
Riepilogo
Esegui una titolazione acido-base per determinare la concentrazione di una soluzione incognita di acido acetico utilizzando un titolante di idrossido di sodio. Questo laboratorio enfatizza le misurazioni visive trattando il menisco della buretta e supporta due diverse configurazioni.
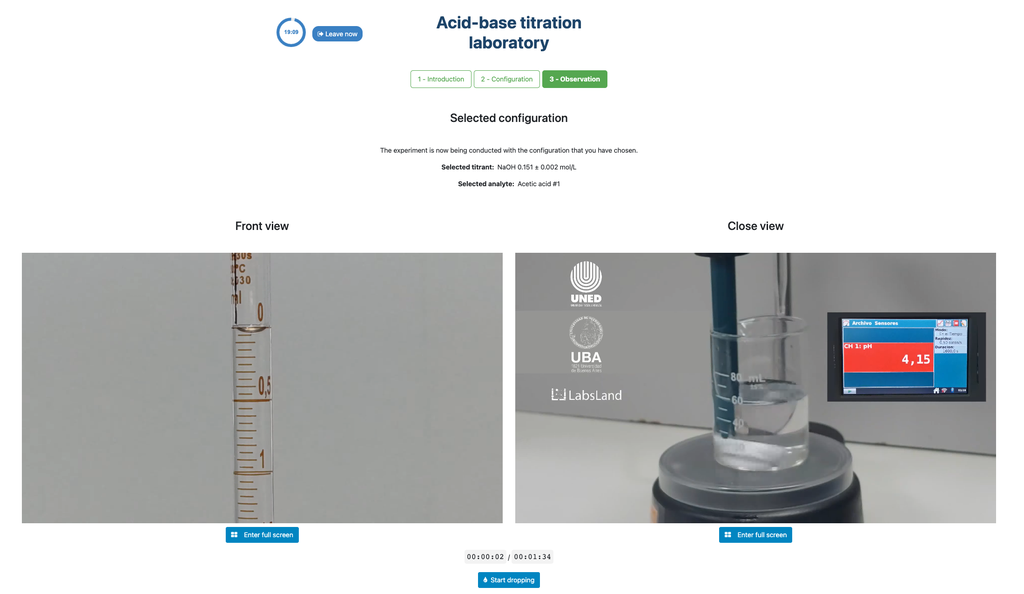
La prima è per un approccio potenziometrico: avrai accesso a un sensore di pH digitale e potrai usarlo per determinare quando la soluzione incognita è stata neutralizzata.
La seconda è per un approccio colorimetrico: puoi fare affidamento sul cambiamento di colore dovuto alla presenza di un indicatore di fenolftaleina, senza avere un sensore di pH digitale a disposizione.
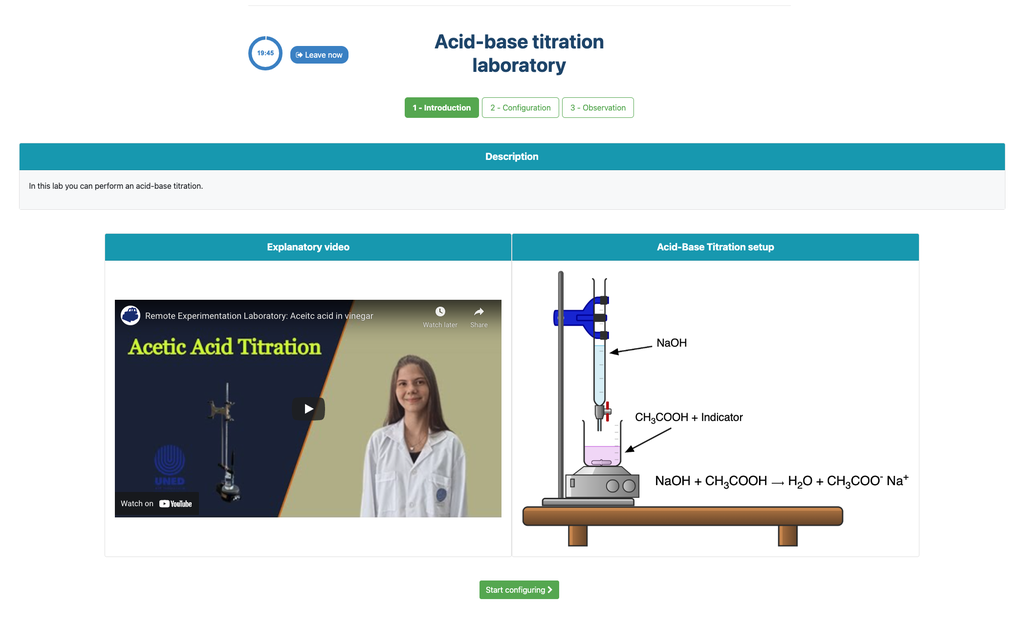
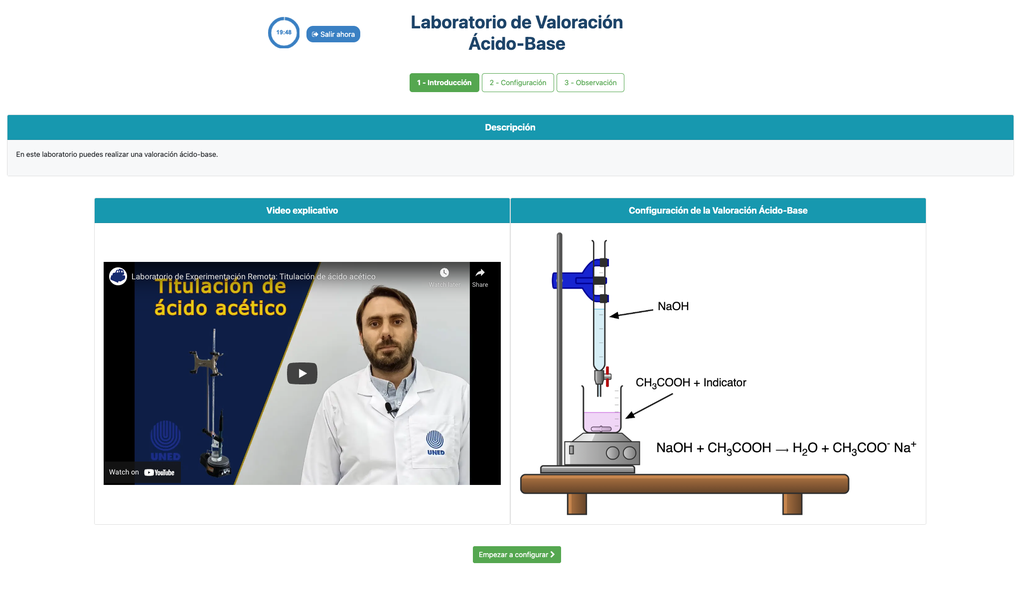
Titolazione acido-base
Le titolazioni sono un metodo volumetrico basato sulla misurazione della quantità di un reattivo a concentrazione nota (noto come standard primario) che viene consumato da un campione a concentrazione sconosciuta noto come analita.
La titolazione viene condotta aggiungendo il titolante all'analita utilizzando una buretta, in modo da ottenere una sostanza chimicamente equivalente tra il titolante e l'analita. Questo è noto come il 'punto di equivalenza' ed è un valore teorico che non può essere determinato sperimentalmente.
La stima sperimentale di questo punto viene ottenuta attraverso un'approssimazione nota come 'punto finale'. Questo è determinato attraverso un cambiamento fisico. In tal caso, il cambiamento di colore della soluzione viene ottenuto dopo aver aggiunto una sostanza indicatrice: una sostanza che cambia colore in determinati intervalli di pH.
Per la titolazione acido-base usiamo un indicatore di fenolftaleina che diventa rosa chiaro dopo un pH di circa 8,4, un valore molto vicino al punto di equivalenza nelle titolazioni acido-base più comuni.
In alternativa, nella configurazione potenziometrica, può essere utilizzato un sensore di pH digitale per determinare il 'punto di equivalenza'.
Approccio colorimetrico vs potenziometrico
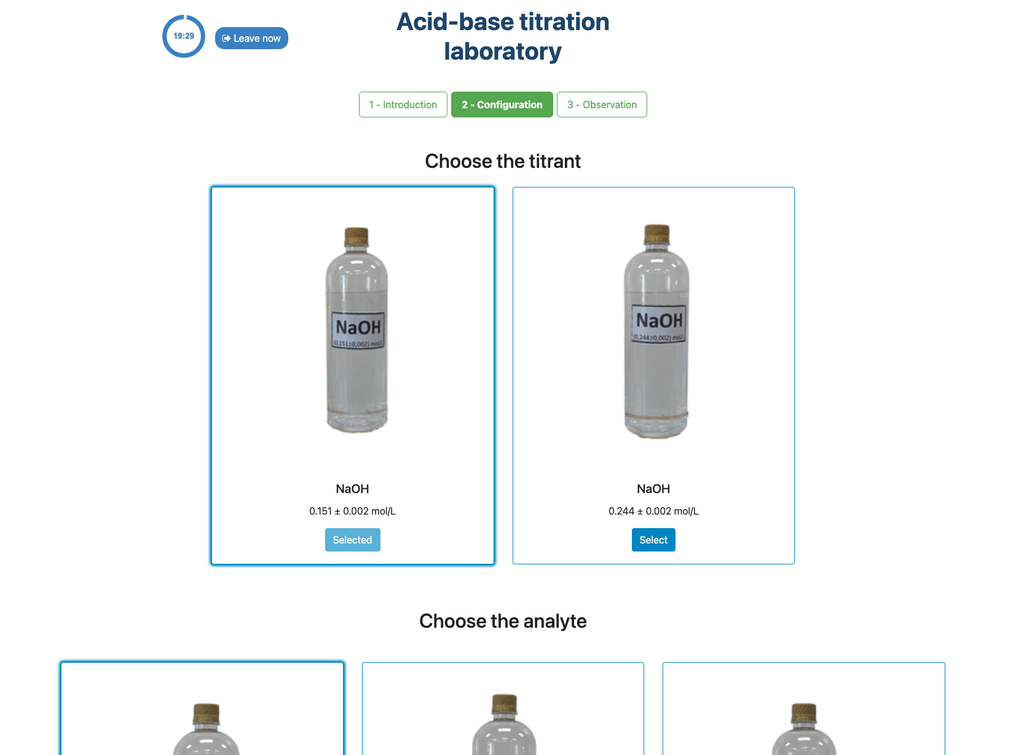
L'approccio colorimetrico si basa sul cambiamento di colore fornito dall'indicatore di fenolftaleina. L'approccio potenziometrico invece si basa sull'aumento del pH misurato dal sensore digitale. In questa versione del laboratorio sono disponibili due diverse configurazioni, una per ciascun approccio. Nella configurazione colorimetrica gli studenti potrebbero non vedere il sensore di pH digitale.
Differenze con il laboratorio di Titolazione Acido-Base II
In questa versione del laboratorio (Titolazione Acido-Base II) è possibile eseguire la titolazione acido-base per una soluzione di acido acetico incognita. Nell'altra versione del laboratorio (vedi Titolazione Acido-Base I) è possibile eseguire la titolazione acido-base per una soluzione di acido citrico invece.
Questa versione del laboratorio enfatizza le misurazioni visive della buretta, compreso leggere correttamente il menisco nella buretta. L'altra versione del laboratorio (vedi Titolazione Acido-Base I) non enfatizza questo, ma si concentra invece sui calcoli.
Inoltre, in questa versione puoi scegliere tra due diverse configurazioni: una per l'approccio potenziometrico e una per l'approccio colorimetrico. La configurazione per l'approccio colorimetrico non mostra il sensore di pH. Nell'altra versione del laboratorio (vedi Titolazione Acido-Base I) vi è una singola configurazione e il sensore è sempre mostrato.
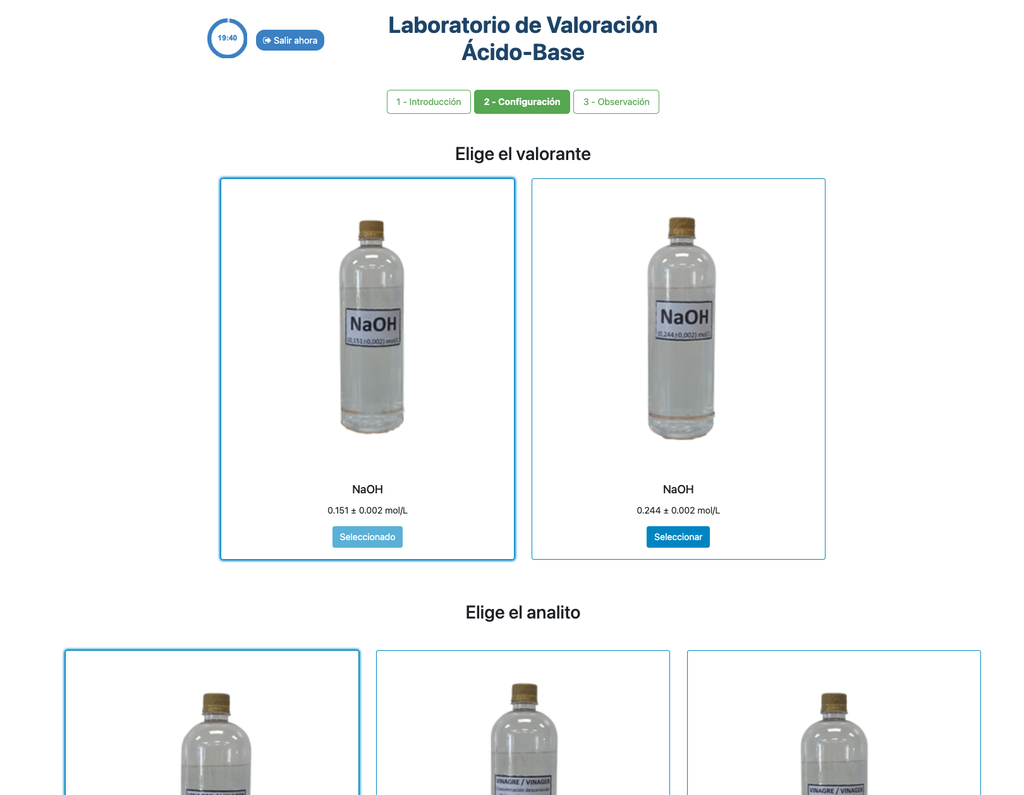
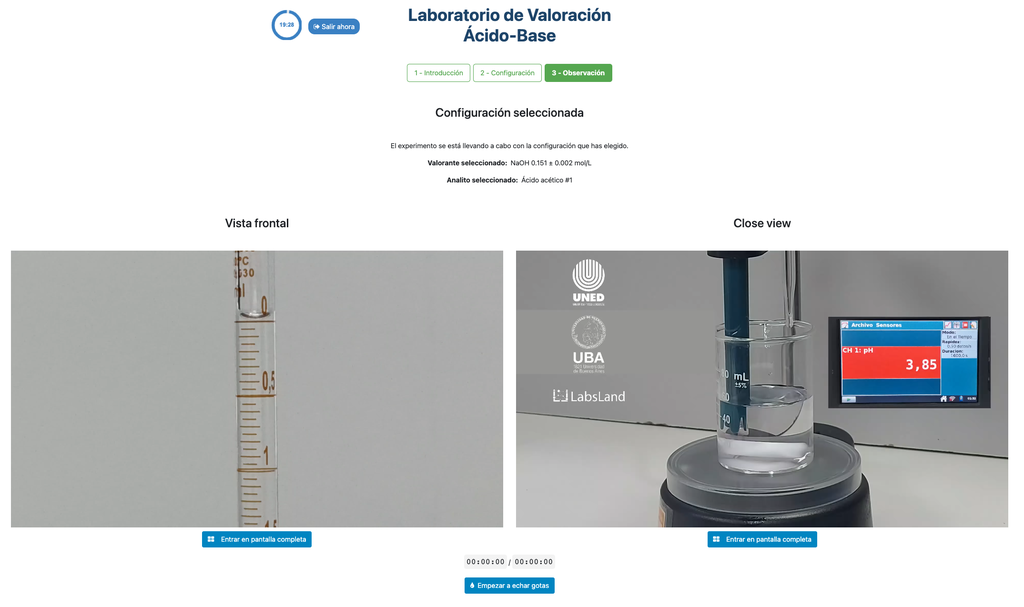
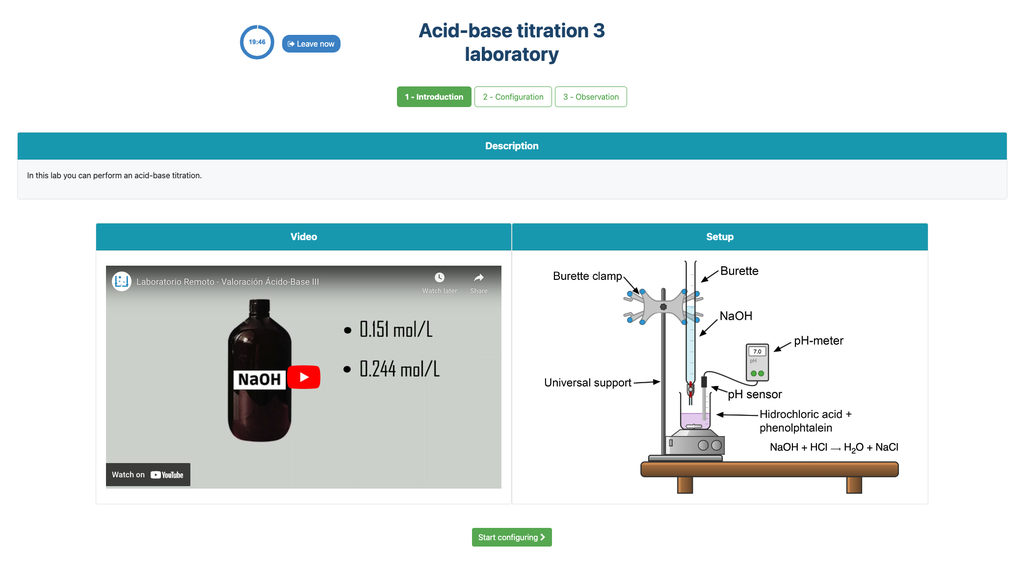
Titolazione Acido-Base III
Riassunto
Esegui una titolazione acido-base per determinare la concentrazione di una soluzione sconosciuta di acido cloridrico utilizzando un titolante d'idrossido di sodio. Questo laboratorio enfatizza misurazioni visive che riguardano il menisco della buretta e supporta due diverse configurazioni.\u00a0
La prima è per un approccio potenziometrico: avrai accesso a un sensore di pH digitale e potrai usarlo per determinare quando la soluzione sconosciuta è stata neutralizzata.\u00a0
La seconda è per un approccio colorimetrico: puoi basarti sul cambiamento di colore dovuto alla presenza di un indicatore di fenolftaleina, senza avere un sensore di pH digitale disponibile.
\u00a0
Titolazione Acido-Base
Le titolazioni sono un metodo volumetrico basato sulla misurazione della quantità di un reattivo a concentrazione nota (noto come standard primario) che viene consumato da un campione a concentrazione sconosciuta noto come analita.
La titolazione viene condotta aggiungendo il titolante all'analita utilizzando una buretta, in modo da ottenere una sostanza chimicamente equivalente tra il titolante e l'analita. Questo è noto come "punto di equivalenza" ed è un valore teorico che non può essere determinato sperimentalmente.
La stima sperimentale di questo punto viene ottenuta attraverso un'approssimazione nota come "punto finale". Questo è determinato attraverso un cambiamento fisico. In questo caso, il cambiamento di colore della soluzione viene ottenuto dopo l'aggiunta di una sostanza indicatrice: una sostanza che cambia colore in determinati intervalli di pH.
Per la titolazione acido-base utilizziamo un indicatore di fenolftaleina che diventa di un rosa chiaro dopo un pH di circa 8,4, un valore molto vicino al punto di equivalenza nelle titolazioni acido-base più comuni.
In alternativa, nella configurazione potenziometrica, può essere utilizzato un sensore di pH digitale per determinare il "punto di equivalenza".
Approccio Colorimetrico vs Potenziometrico
L'approccio colorimetrico si basa sul cambiamento di colore fornito dall'indicatore di fenolftaleina. L'approccio potenziometrico invece si basa sull'aumento del pH misurato dal sensore digitale. In questa versione del laboratorio sono disponibili due diverse configurazioni, una per ciascun approccio. Nella configurazione colorimetrica gli studenti potrebbero non vedere il sensore di pH digitale.
Differenze con gli altri laboratori di titolazione
In questa versione del laboratorio (Titolazione Acido-Base II) puoi eseguire la titolazione acido-base per una soluzione sconosciuta di acido cloridrico. In altre versioni del laboratorio puoi eseguire la titolazione acido-base per una soluzione di acido citrico invece (Titolazione Acido-Base I), e acido acetico (Titolazione Acido-Base II).
Sia questa versione del laboratorio (Titolazione Acido-Base III) che Titolazione Acido-Base II enfatizzano misurazioni visive della buretta, inclusa la corretta lettura del menisco nella buretta. L'altra versione del laboratorio (vedi Titolazione Acido-Base I) non enfatizza questo, e si concentra invece sui calcoli.
Inoltre, in queste versioni puoi scegliere tra due diverse configurazioni: una per l'approccio potenziometrico e una per l'approccio colorimetrico. La configurazione per l'approccio colorimetrico non mostra il sensore di pH. In un'altra versione del laboratorio (vedi Titolazione Acido-Base I) c'è una singola configurazione e il sensore è sempre mostrato.
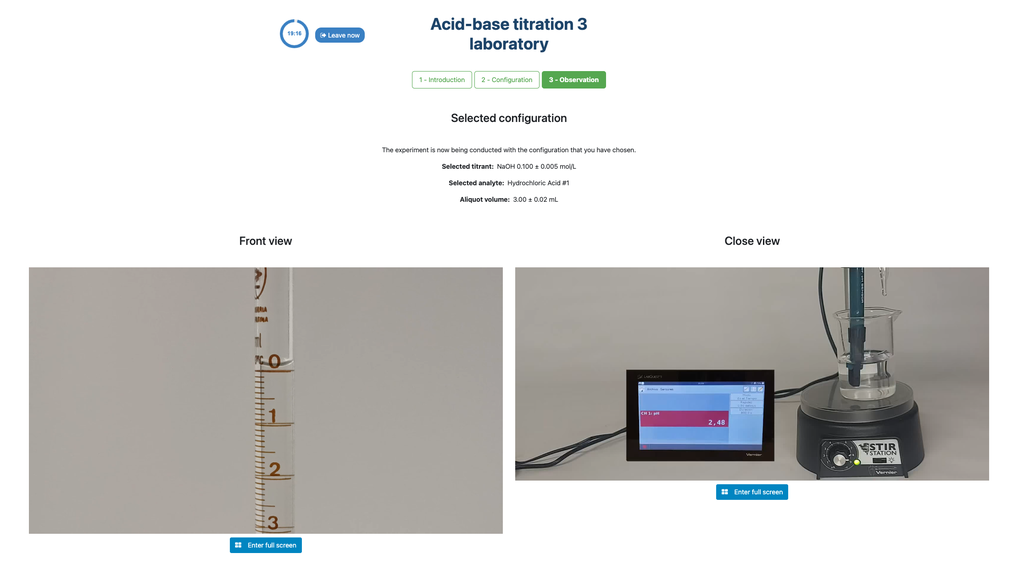
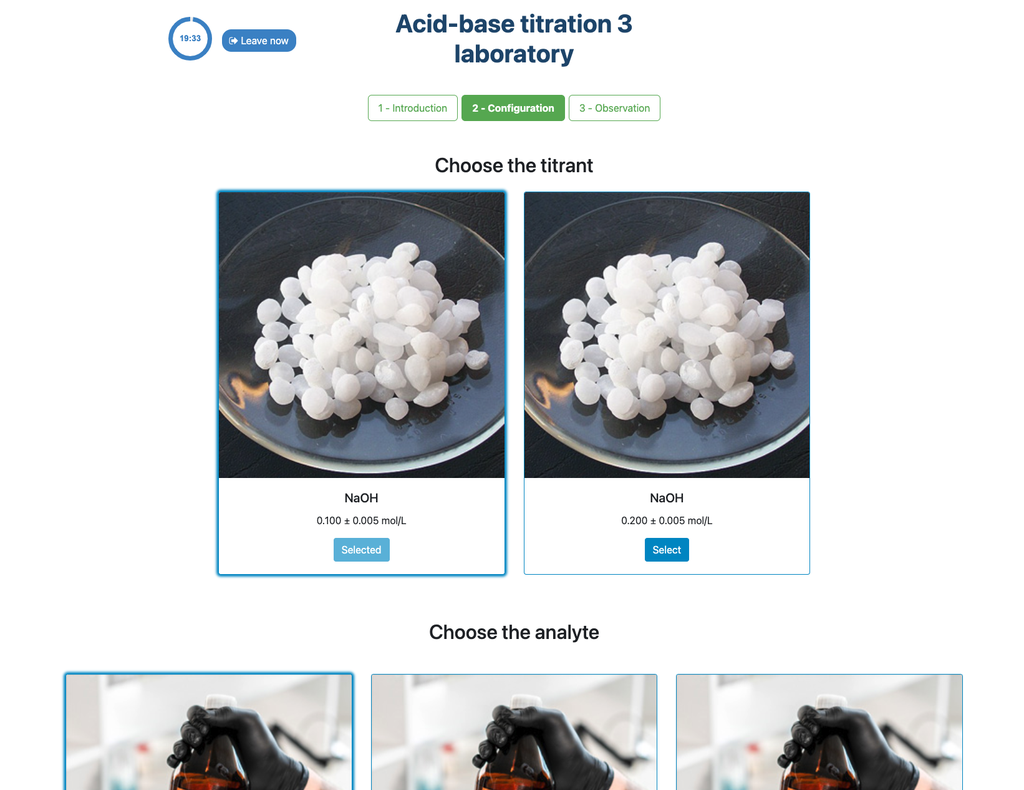

Titolazione acido-base I
Riassunto
Esegui una titolazione acido-base per determinare la concentrazione di una soluzione sconosciuta di acido citrico utilizzando un titolatore di idrossido di sodio. È sempre disponibile un sensore di pH digitale e un indicatore di fenolftaleina è stato applicato alla soluzione sconosciuta in modo che possa essere utilizzato sia un approccio potenziometrico che colorimetrico. È anche disponibile un grafico in tempo reale.
Titolazione Acido-Base
Le titolazioni sono un metodo volumetrico basato sulla misurazione della quantità di un reattivo a concentrazione nota (noto come standard primario) che viene consumato da un campione a concentrazione sconosciuta noto come analita.
La titolazione viene condotta aggiungendo il titolatore all'analita utilizzando una buretta, in modo da ottenere una sostanza chimicamente equivalente tra il titolatore e l'analita. Questo è conosciuto come il "punto di equivalenza" ed è un valore teorico che non può essere determinato sperimentalmente.
L'estimazione sperimentale di questo punto viene ottenuta attraverso un'approssimazione nota come "punto finale". Questo è determinato attraverso un cambiamento fisico. In tal caso, il cambiamento di colore della soluzione viene raggiunto dopo aver aggiunto una sostanza indicatrice: una sostanza che cambia colore in determinati intervalli di pH.
Per la titolazione acido-base utilizziamo un indicatore di fenolftaleina che diventa di un rosa chiaro dopo un pH di circa 8,4, che è un valore molto vicino al punto di equivalenza nelle titolazioni acido-base più comuni.
Approcci Colorimetrici vs Potenziometrici
L'approccio colorimetrico si basa sul cambiamento di colore fornito dall'indicatore di fenolftaleina. L'approccio potenziometrico si basa invece sull'aumento del pH misurato dal sensore digitale. In questa versione del laboratorio di titolazione acido-base possono essere utilizzati entrambi gli approcci. Il sensore digitale è sempre disponibile e non può essere nascosto.
Differenze con il laboratorio di Titolazione Acido-Base II
In questa versione del laboratorio (Titolazione Acido-Base I) puoi eseguire la titolazione acido-base per una soluzione sconosciuta di acido citrico. Nell'altra versione del laboratorio (vedi Titolazione Acido-Base II) puoi invece eseguire la titolazione acido-base per una soluzione di acido acetico.
Questa versione del laboratorio enfatizza i calcoli ma non ha tra i suoi obiettivi didattici le misurazioni visive della buretta. L'altra versione del laboratorio (vedi Titolazione Acido-Base II) enfatizza le misurazioni visive, e gli studenti devono imparare a leggere correttamente il menisco della buretta.
Inoltre, in questa versione c'è un'unica esperienza che può essere utilizzata sia per l'approccio colorimetrico che potenziometrico. Nell'altra versione del laboratorio (vedi Titolazione Acido-Base II) ci sono due configurazioni disponibili, in una delle quali il sensore digitale è nascosto in modo che gli studenti possano fare affidamento solo sul cambiamento di colore.
Legge di Boyle
Riepilogo
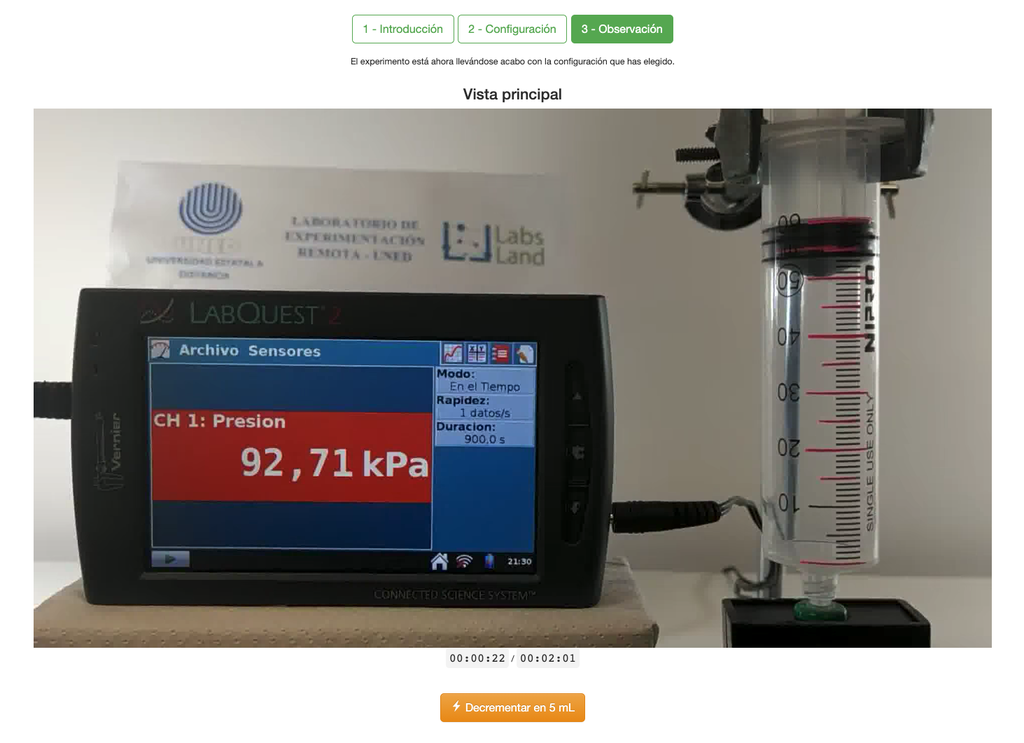
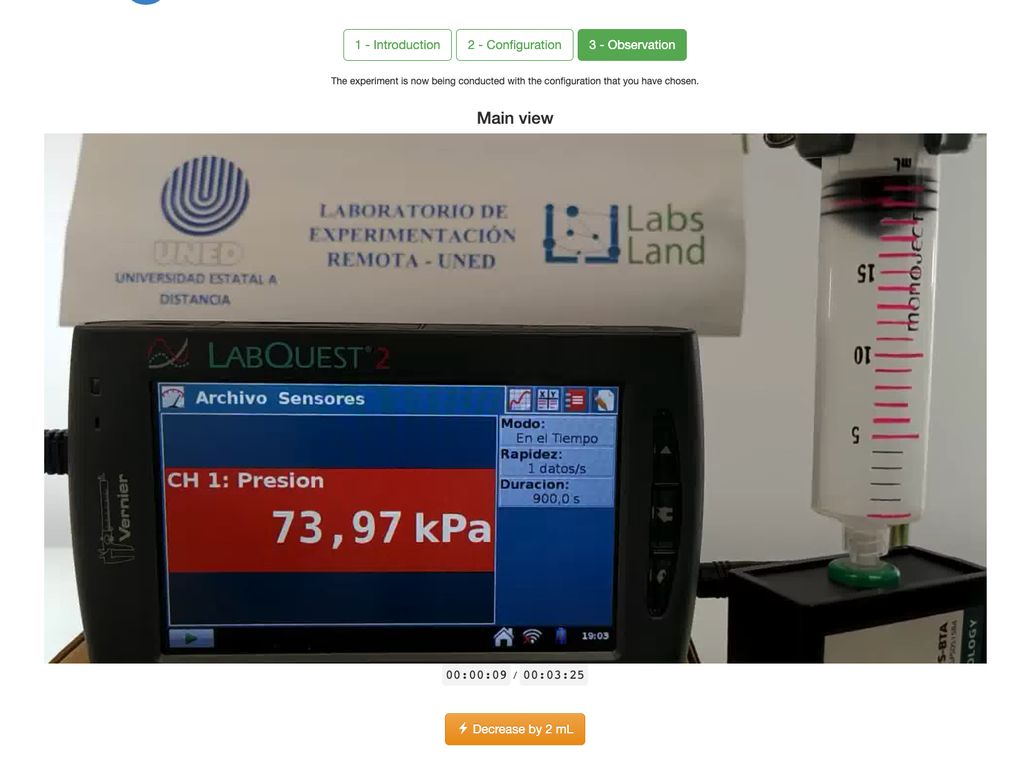
Il laboratorio della Legge di Boyle permette agli studenti di determinare la relazione tra pressione e volume di un gas a temperatura ambiente e costante. Gli studenti possono scegliere tra due diverse siringhe di volume e misurare la pressione del gas mentre riducono il volume. L'esperimento si riflette in un'analisi grafica sotto forma di isoterma. In questo modo, possono verificare la Legge di Boyle e imparare il comportamento dei gas in maniera pratica e accessibile.
La Legge di Boyle
La Legge di Boyle afferma che a temperatura costante, il volume di un gas è inversamente proporzionale alla sua pressione. Ciò significa che quando la pressione di un gas aumenta, il suo volume diminuisce, e viceversa. La Legge di Boyle può essere espressa matematicamente come:
V ndür 1/P
Dove V è il volume del gas e P è la pressione del gas.
Il laboratorio della Legge di Boyle permette agli studenti di mettere in pratica questa legge e verificarla in un contesto sperimentale. Misurando il volume e la pressione del gas in momenti diversi, possono tracciare un grafico isoterma che mostra come il volume del gas cambia in base alla sua pressione. Se il grafico isoterma si adatta alla Legge di Boyle, allora gli studenti hanno verificato sperimentalmente la legge.
Svolgere esperimenti come questo è un modo eccellente per apprendere il comportamento dei gas e come le diverse variabili sono correlate. Inoltre, gli esperimenti pratici possono essere più accessibili e memorabili per gli studenti rispetto alla semplice lettura della legge su un libro di testo. Il grafico isoterma visualizza chiaramente il comportamento del gas e verifica se le previsioni della Legge di Boyle sono rispettate.
Applicazione nell'Istruzione Secondaria e Universitaria
Il laboratorio della Legge di Boyle è tipicamente applicato nei corsi di scienze a livello di scuola superiore e nei corsi di chimica a livello universitario. A livello di scuola superiore, il laboratorio può essere applicato in un corso di scienze dove si studiano i concetti base di chimica e fisica, come la pressione e il volume dei gas. All'università, il laboratorio della Legge di Boyle può essere applicato in un corso di chimica più avanzato dove si approfondisce lo studio dei gas e il loro comportamento.
Obiettivi
Un laboratorio della Legge di Boyle può avere diversi obiettivi educativi a seconda del livello educativo a cui è applicato. Ecco alcuni esempi di obiettivi che un laboratorio della Legge di Boyle può avere sia a livello di scuola superiore che universitario:
A livello di scuola superiore:
- Gli studenti comprendono la Legge di Boyle e la sua importanza nella fisica dei gas.
- Gli studenti praticano abilità sperimentali e di osservazione.
- Gli studenti sviluppano abilità di analisi e rappresentazione dei dati.
- Gli studenti comprendono la relazione tra temperatura, pressione e volume dei gas.
A livello universitario:
- Gli studenti conoscono la Legge di Boyle e la sua importanza nella fisica dei gas.
- Gli studenti dimostrano abilità sperimentali e di osservazione in laboratorio.
- Gli studenti applicano concetti teorici di fisica dei gas in situazioni pratiche.
- Gli studenti sviluppano abilità di analisi e rappresentazione dei dati in un contesto scientifico.
- Gli studenti comprendono come temperatura, pressione e volume dei gas si relazionano in diverse situazioni.
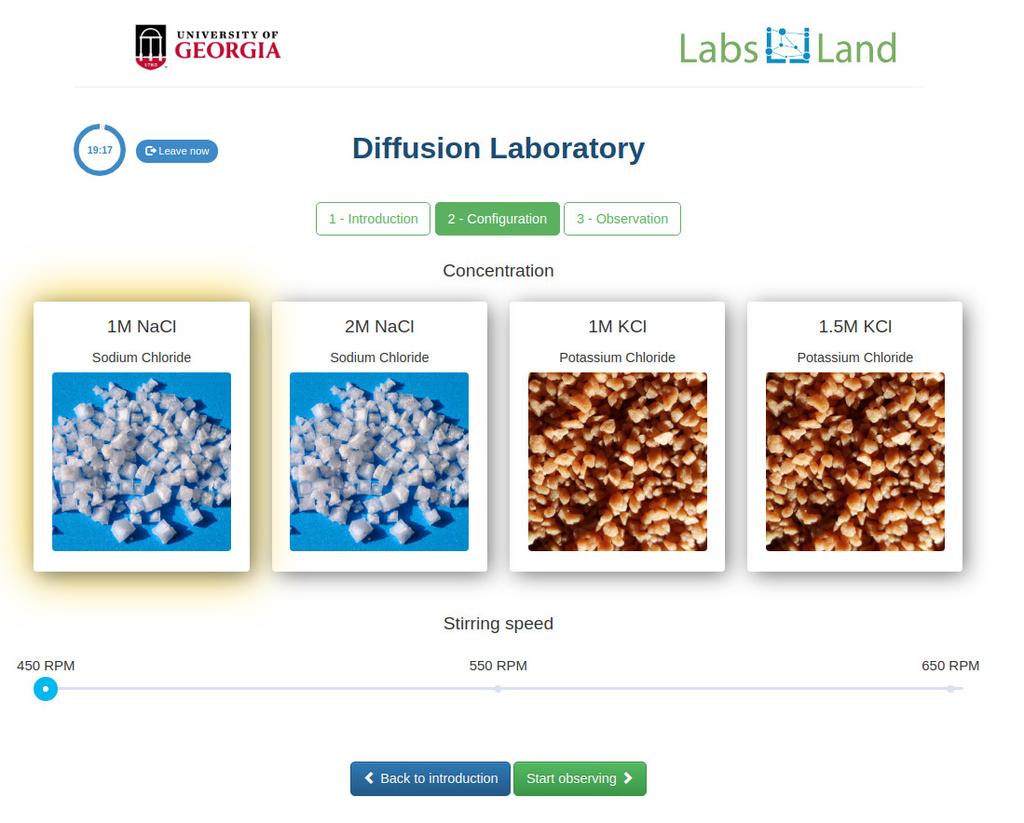
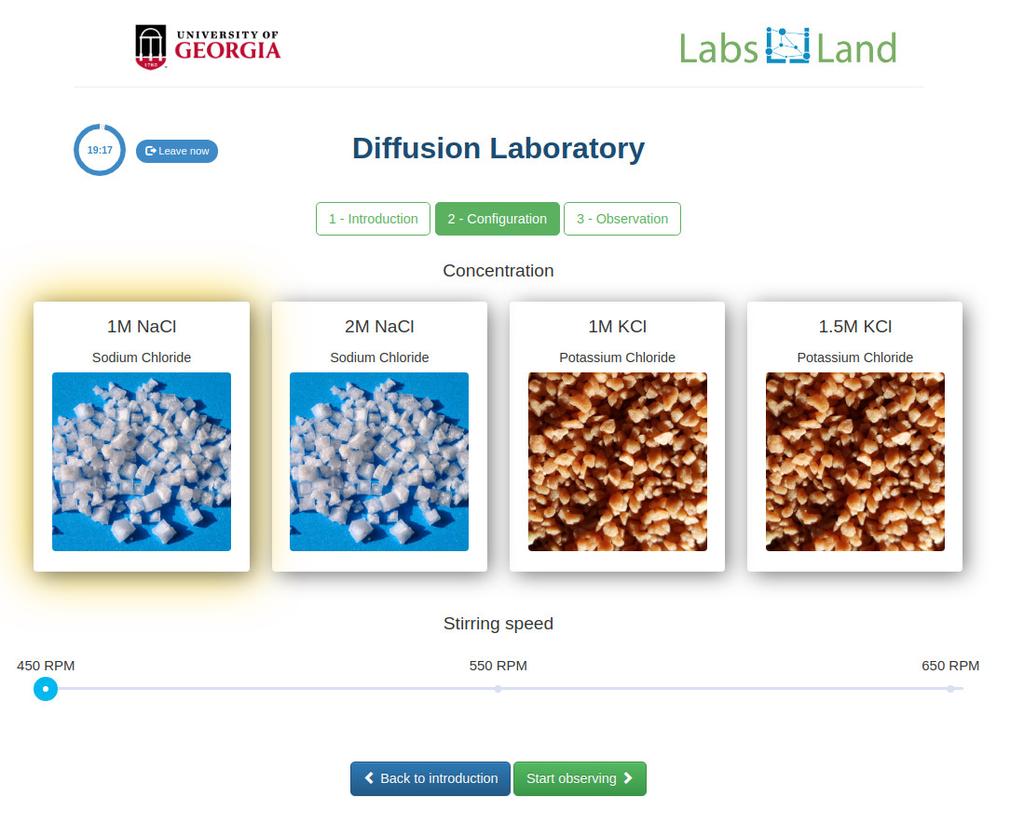
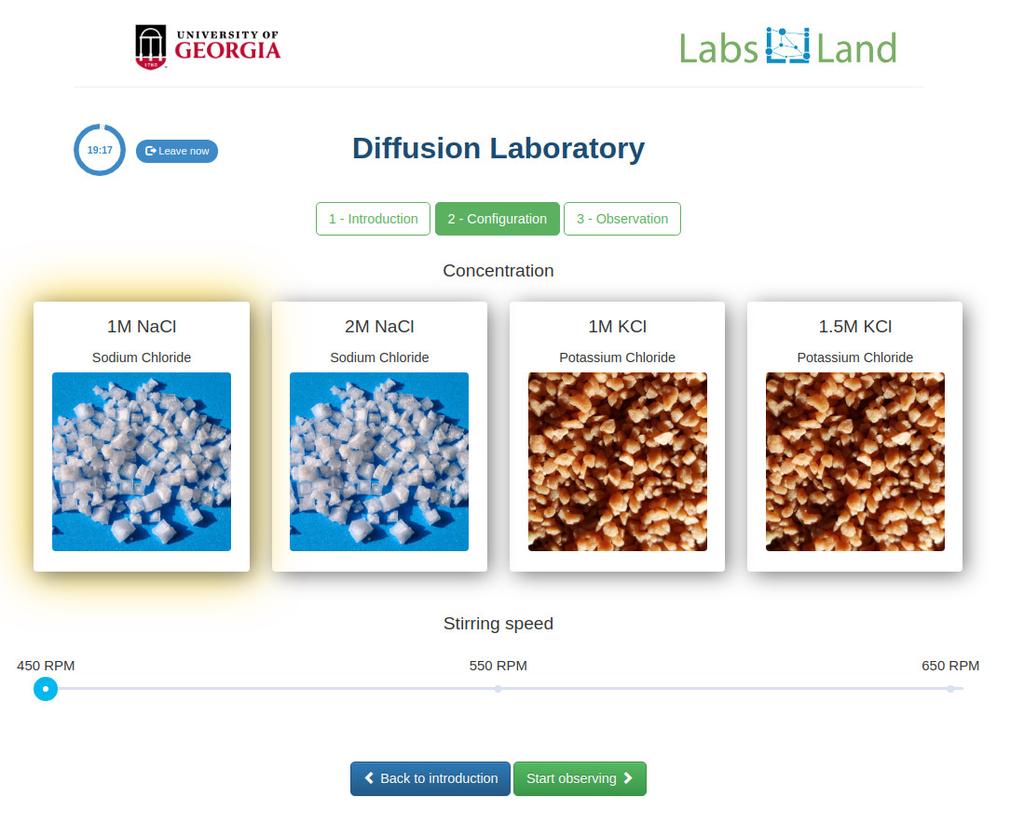
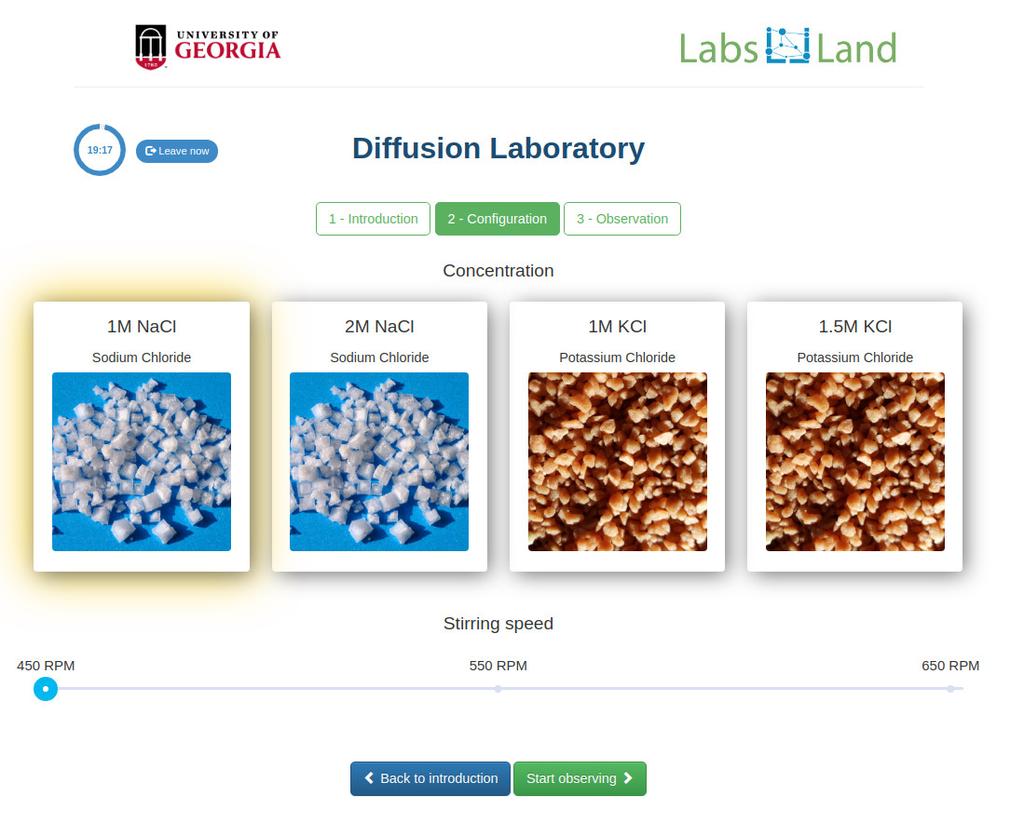
Diffusion laboratory - basic
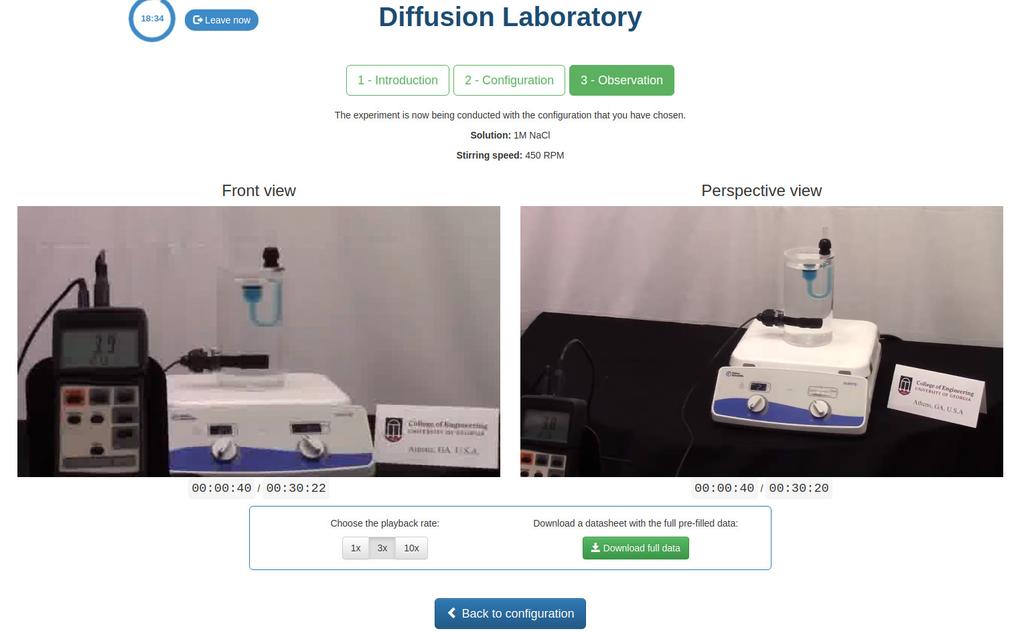
Diffusion laboratory - data
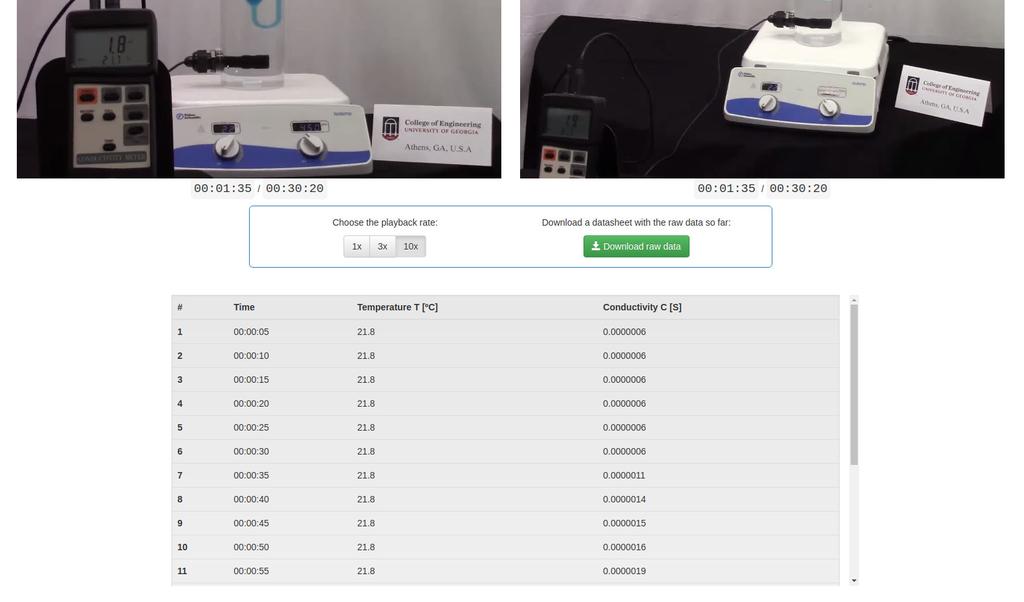
Diffusion laboratory - full
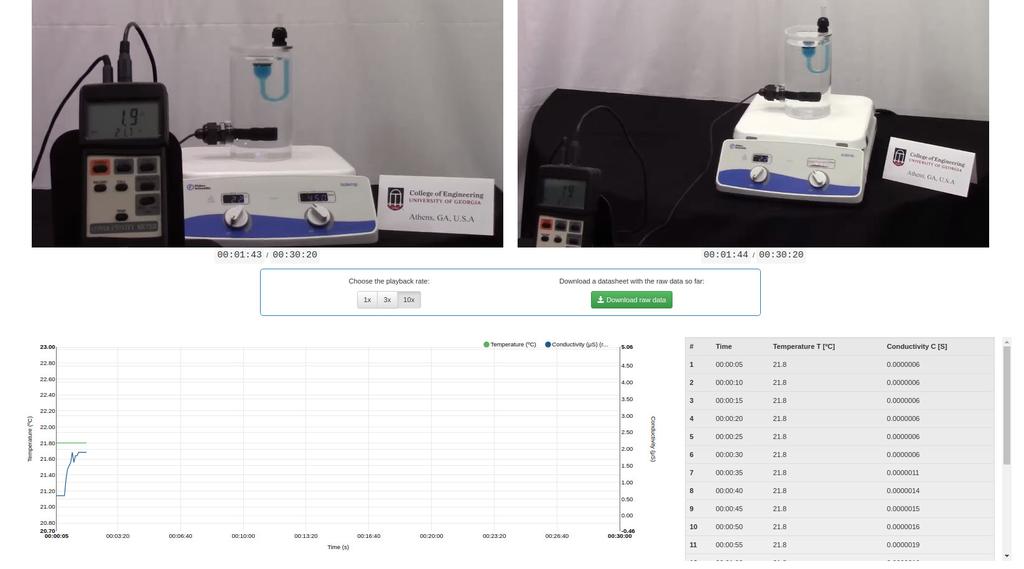
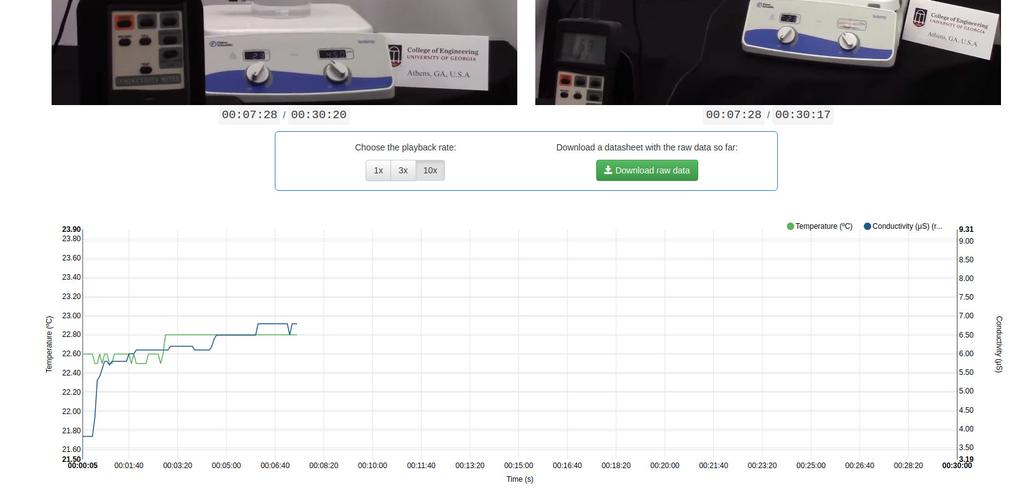
Diffusion laboratory - plot
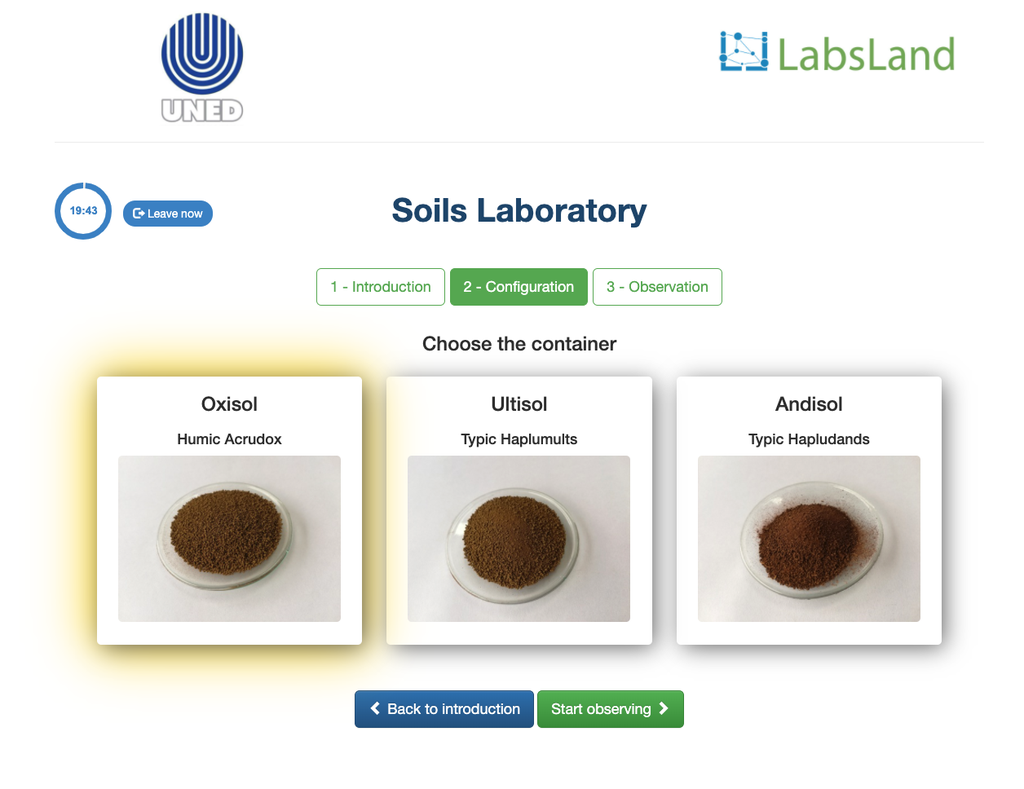
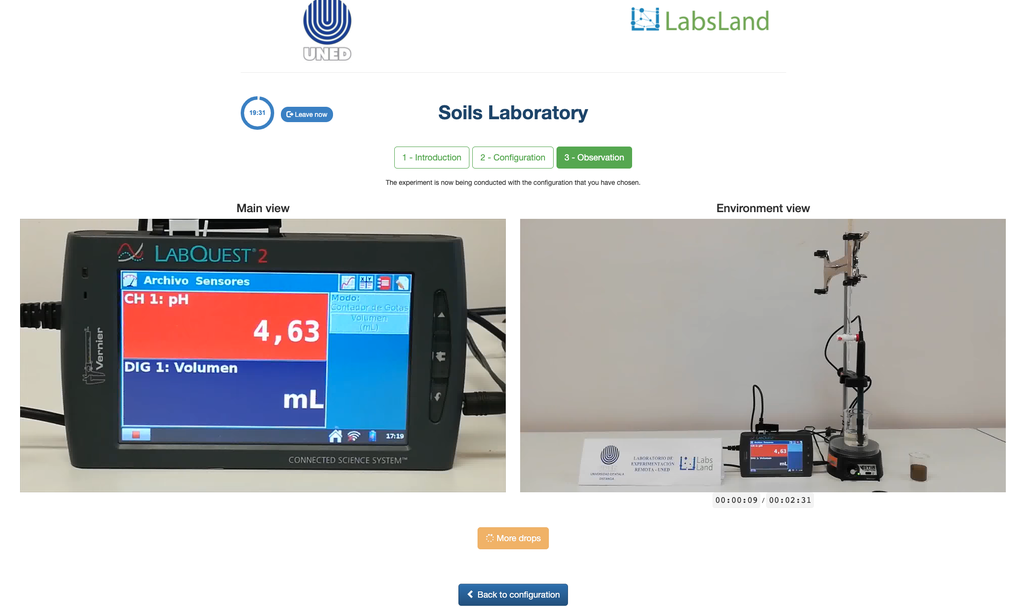
Acidità Scambiabile dei Suoli
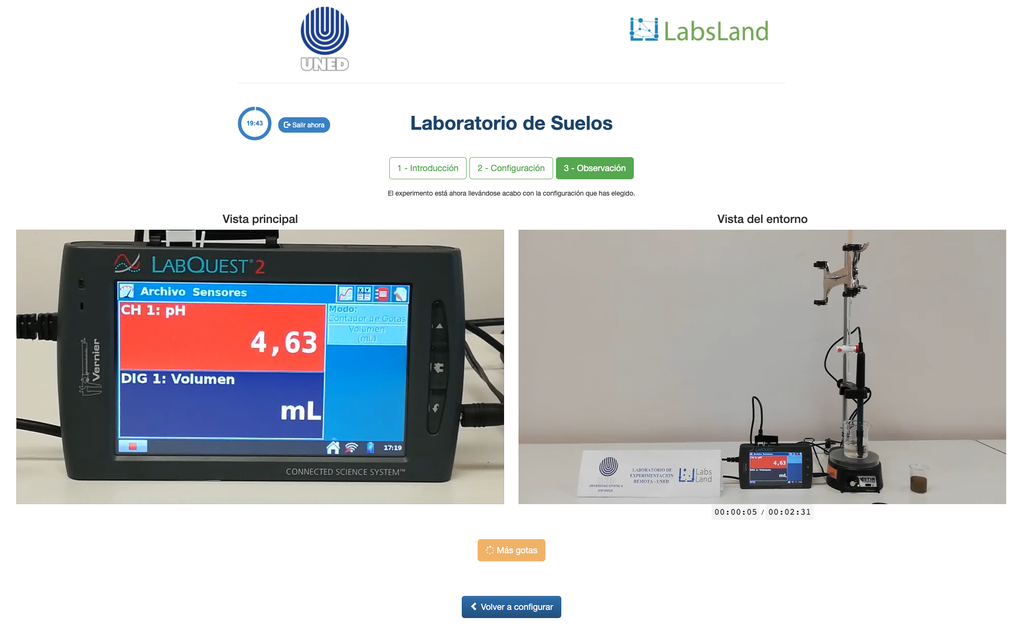
L'acidità dei suoli può verificarsi a causa di vari processi che favoriscono una riduzione del pH. Questi processi si verificano naturalmente o per azione umana. Le principali fonti di acidità del suolo sono associate agli ioni di idrogeno (H+) e agli ioni di alluminio (Al+3) nella soluzione del suolo. L'acidità scambiabile è determinata attraverso l'uso di soluzioni di sali neutri come il cloruro di potassio (KCl). Gli ioni acidi (alluminio e idronio) che sono trattenuti nella frazione colloidale del suolo, in presenza di un ione spostante (K+), entrano nella soluzione del suolo. Successivamente, quella soluzione viene titolata con una soluzione di idrossido di sodio della concentrazione esatta per raggiungere l'ultimo punto della reazione di neutralizzazione utilizzando la fenolftaleina come indicatore.

Legge di Gay-Lussac
La legge di Gay-Lussac ci permette di studiare il comportamento dei gas ed è spesso studiata in fisica e chimica. Essa mette in relazione la pressione di un gas con la sua temperatura, mentre altri parametri come il volume e la quantità rimangono costanti.
Esistono vari modi per verificare la legge di Gay-Lussac. In questo esperimento verificheremo che, per una data quantità di gas, la pressione è direttamente proporzionale alla temperatura.
Radioattività
Riassunto
La configurazione, utile per scuole e università, include un contatore Geiger che può misurare il numero di collisioni di particelle rilevate. L'utente può scegliere tra diverse fonti radioattive, nonché un assorbitore da mettere tra la fonte radioattiva e la sonda. Inoltre, altri parametri che gli utenti possono variare sono la distanza e il numero di test. Questo permette di realizzare una vasta gamma di esperimenti e opportunità di apprendimento.
Radioattività
La radioattività è il processo in cui un nucleo atomico perde energia emettendo particelle e radiazioni. Questo può avvenire naturalmente in determinati elementi, o artificialmente attraverso l'uso di reazioni nucleari. Nel contesto della fisica nelle scuole e nelle università, lo studio della radioattività può fornire preziosi spunti sulla natura fondamentale della materia e sulle leggi della fisica.
Un esperimento comune in questo ambito è la misurazione della radioattività utilizzando un contatore Geiger. Questo strumento è in grado di rilevare l'emissione di particelle da una fonte radioattiva, permettendo agli studenti di comprendere i principi fondamentali della radiazione e dei suoi effetti sulla materia. Variando il tipo di fonte radioattiva, la distanza tra la fonte e il rilevatore, e il tipo di materiale assorbente posto tra i due, gli studenti possono esplorare una vasta gamma di fenomeni e ottenere una comprensione più profonda dei principi sottostanti.
Oltre al suo valore educativo, lo studio della radioattività ha anche applicazioni pratiche in campi come la medicina, la produzione di energia e la protezione ambientale. Perciò, è un tema importante da apprendere per gli studenti, sia per il suo interesse intrinseco che per le molte applicazioni nel mondo reale.
Applicazioni reali della radioattività
Una delle applicazioni più comuni della radioattività è nel campo della medicina. Gli isotopi radioattivi sono utilizzati in tecniche di imaging medico come le scansioni PET e SPECT, che permettono ai medici di vedere all'interno del corpo e diagnosticare malattie. Gli isotopi radioattivi sono anche utilizzati nei trattamenti contro il cancro, come la radioterapia, dove sono impiegati per uccidere le cellule cancerose.
La radioattività è anche utilizzata in industrie come l'esplorazione di petrolio e gas, dove viene impiegata per misurare la permeabilità delle formazioni rocciose e il flusso dei fluidi attraverso di esse. Gli isotopi radioattivi sono anche utilizzati nei rilevatori di fumo e nella produzione di orologi e strumenti luminosi.
In generale, la radioattività ha una vasta gamma di applicazioni in campi come la medicina, l'industria e persino i prodotti di consumo quotidiani. Continua ad essere un importante area di studio in fisica e altre scienze, e le sue applicazioni continuano ad espandersi con lo sviluppo di nuove tecnologie.
Esperimenti sulla radioattività nelle scuole e nelle università
L'uso di un contatore Geiger in un esperimento sulla radioattività permette un ampio ventaglio di possibilità. Variando gli emettitori e gli assorbitori di radiazioni, gli studenti possono osservare gli effetti di diverse fonti e materiali sulle collisioni di particelle rilevate. Questo può aiutare gli studenti a comprendere le proprietà della radioattività e il comportamento delle diverse particelle.
Inoltre, si possono condurre esperimenti riguardanti la determinazione del tipo di particelle radiate osservando se la particella viene assorbita o meno. Posizionando diversi assorbitori tra la fonte e la sonda, gli studenti possono determinare le proprietà delle particelle emesse e ottenere una comprensione più approfondita della radioattività.
Infine, si possono condurre anche esperimenti riguardanti la determinazione della forma geometrica dell'emissione radioattiva utilizzando un contatore Geiger. Misurando attentamente le collisioni di particelle rilevate a diverse distanze, gli studenti possono ottenere spunti sulla distribuzione spaziale della radioattività. Questo può aiutare gli studenti a comprendere i principi fondamentali della radioattività e delle sue applicazioni nel mondo reale.
Obiettivi potenziali di apprendimento
Gli obiettivi potenziali delle attività condotte nel laboratorio sono i seguenti:
- Comprendere le proprietà e il comportamento delle emissioni radioattive.
- Condurre esperimenti per misurare gli effetti della radiazione su diversi materiali.
- Determinare il tipo di radiazione emessa da una fonte radioattiva.
- Comprendere i principi della sicurezza e della gestione delle radiazioni.
- Indagare le applicazioni della radioattività in campi come la medicina, l'industria e la ricerca.
- Comprendere i principi dei contatori Geiger e il loro uso per misurare la radioattività.
- Comprendere lo sviluppo storico del concetto di radioattività e la sua scoperta.
- Esplorare le implicazioni etiche dell'uso dei materiali radioattivi.

Spettroscopia
Questo laboratorio ultraconcorrente è basato su una pratica sperimentale sulla spettroscopia a raggi X utilizzando un dispositivo della marca LEYBOLD che è installato in un laboratorio di strumentazione radiologica presso l'Università Nazionale della Costa Rica (Universidad Nacional de Costa Rica), situato nell'edificio della Fisica Medica Applicata.
L'assemblaggio consiste in un tubo a raggi X con anodo in oro (Au), insieme a un rilevatore a scintillazione configurato con un preamplificatore e un digitalizzatore che consente di elaborare le informazioni delle misurazioni effettuate dal rilevatore attraverso il software.
Il test mira a caratterizzare il fascio della sorgente di radiazione attraverso il calcolo sperimentale dello spettro del fascio di raggi X prodotto nel tubo, oltre a generare nozioni di base sulla strumentazione radiologica e su come la variazione dei suoi parametri è utilizzata in applicazioni industriali e mediche.











