Verkrijg nu toegang tot LCAL2003: Chemistry labs (ultraconcurrent)
Voor slechts:
US$ 9,99Een betaling
6 maanden toegang
Ondersteunde betaalmethoden:
- DigiKey (Niet beschikbaar in elk land)
- Krediet- of debetkaart
- PayPal
Je moet een LabsLand-account aanmaken of gebruiken om verder te gaan.
Toegang op afstand tot 12 laboratoria inbegrepen:
Probeer je meerdere licenties voor een klas te kopen? Neem contact met ons op voor kwantumkortingen
Wat is LabsLand?
LabsLand is het wereldwijde netwerk van afstandslaboratoria.
De apparatuur is altijd echt, geen simulatie.
Je bedient de echte apparatuur met webcams via het internet.
Toegang nu. Geen noodzaak om te wachten tot apparatuur wordt verzonden.
Geen verborgen kosten: alles inbegrepen. Geen accessoires of verzendkosten.
Zeer gemakkelijk te gebruiken: de apparatuur werkt al.
Huur het alleen de maanden dat je het nodig hebt voor je studie.
Hoe werkt LabsLand?
LabsLand is een wereldwijd netwerk van echte laboratoria die online beschikbaar zijn. Studenten (van scholen, universiteiten en platforms voor levenslang leren) kunnen toegang krijgen tot de echte laboratoria via het internet, met behulp van hun laptop, tablet of telefoon.
De laboratoria zijn ofwel in real-time (Arduino, FPGAs...) gevestigd in verschillende universiteiten over de hele wereld. In bepaalde vakgebieden (Natuurkunde, Biologie, Chemie) zijn de laboratoria LabsLand Ultraconcurrent Laboratories, zodat de universiteit alle mogelijke combinaties heeft opgenomen van wat er in het laboratorium kan worden gedaan (in sommige gevallen meerdere duizenden) en deze op een interactieve manier beschikbaar stelt.
In ieder geval is het laboratorium altijd echt (niet gesimuleerd) en beschikbaar via het web (je hoeft geen hardware te verkrijgen, je hoeft je niet bezig te houden met verzending, enz.).
Bekijk hoe een typische gebruikerssessie werkt in de volgende video:
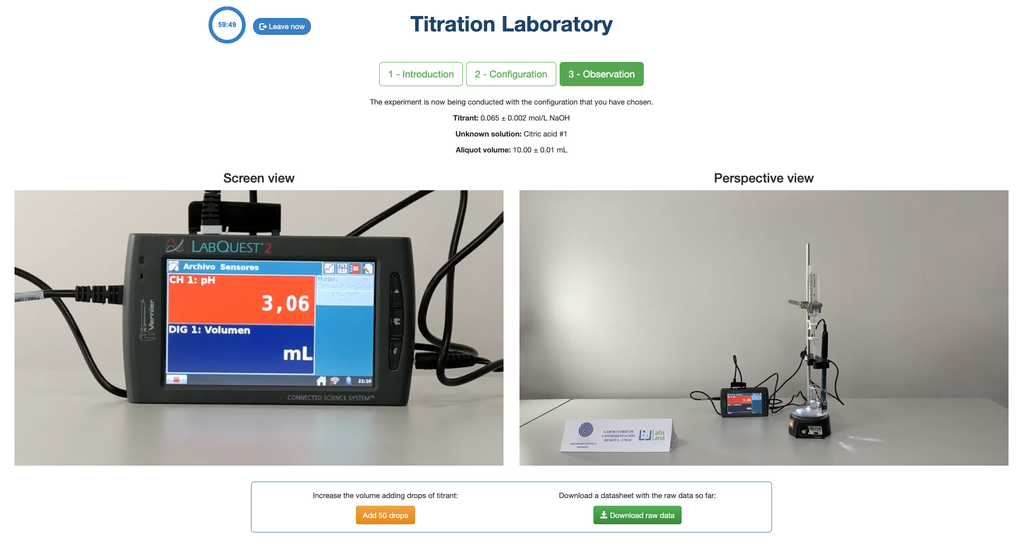
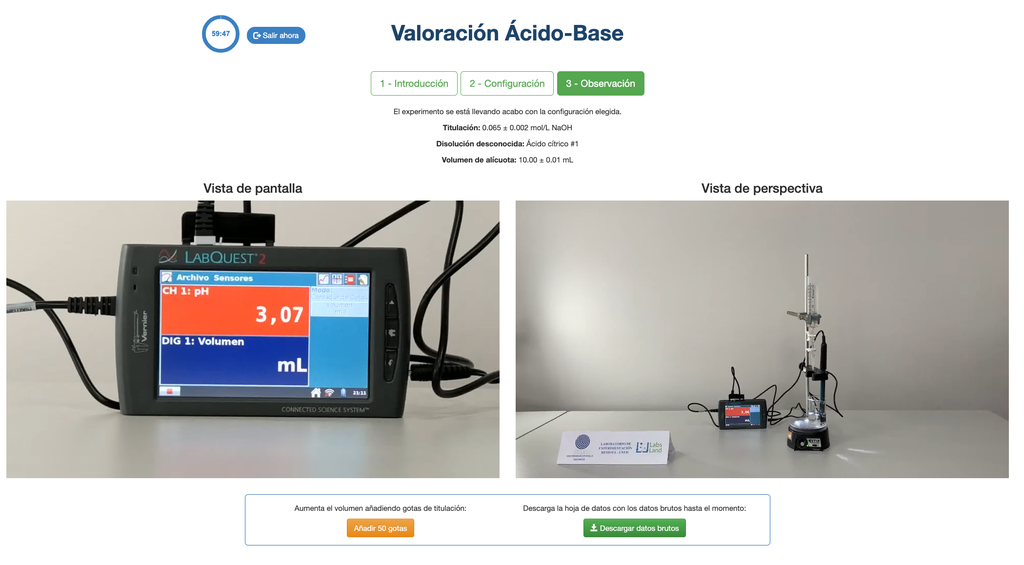
Zuur-base-titratie II
Samenvatting
Voer een zuur-base titratie uit om de concentratie van een onbekende azijnzuuroplossing te bepalen met behulp van een natriumhydroxide-titrant. Dit laboratorium benadrukt visuele metingen met betrekking tot de meniscus van de buret en ondersteunt twee verschillende configuraties.
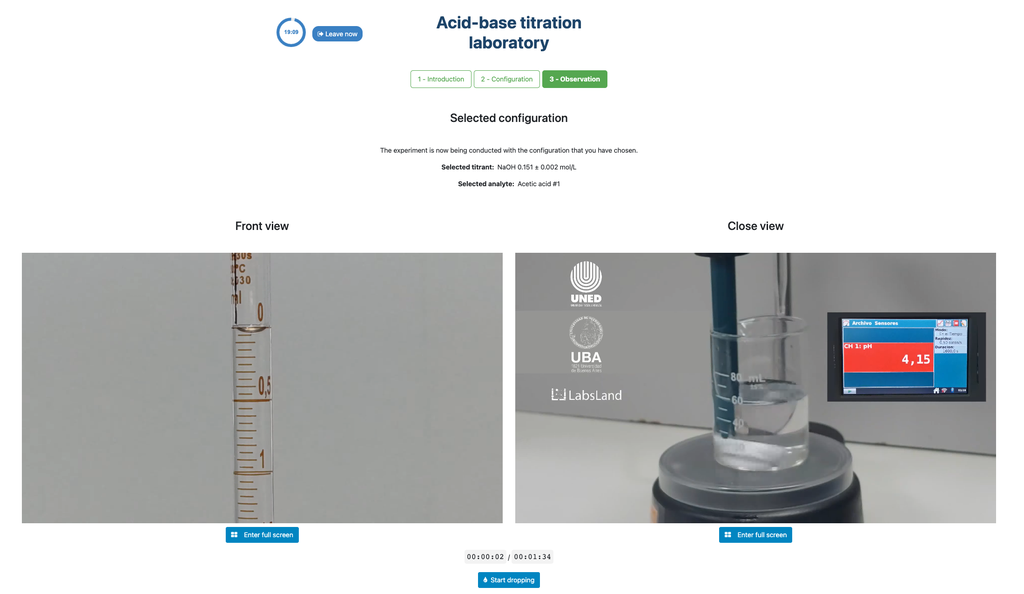
De eerste is voor een potentiometrische aanpak: je hebt toegang tot een digitale pH-sensor en je kunt deze gebruiken om te bepalen wanneer de onbekende oplossing geneutraliseerd is.
De tweede is voor een colorimetrische aanpak: je kunt vertrouwen op de kleurverandering door de aanwezigheid van een fenolftaleïne-indicator, zonder een digitale pH-sensor beschikbaar te hebben.
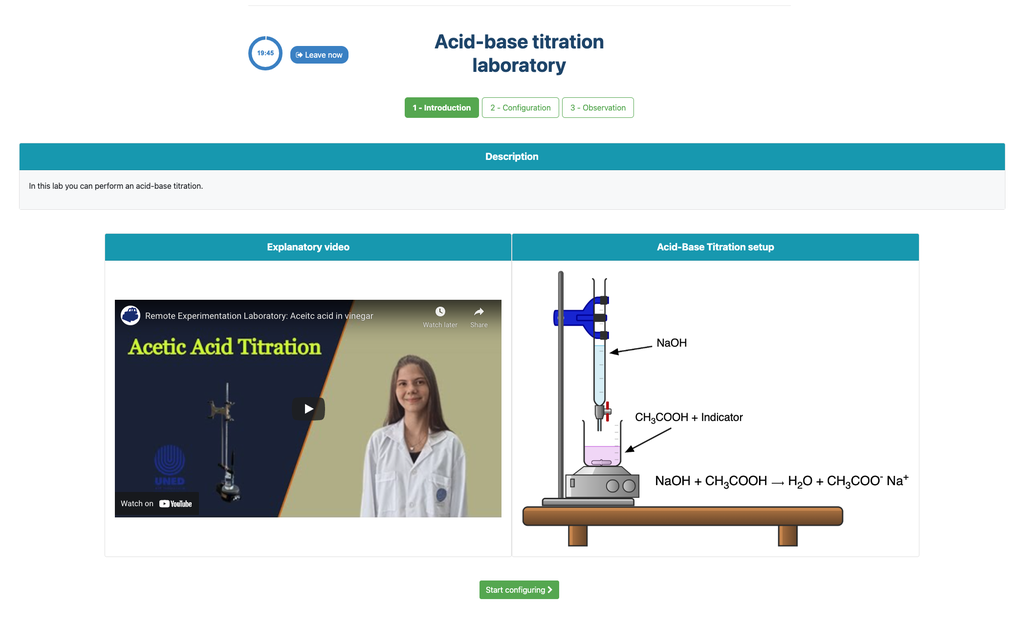
Zuur-base Titratie
Titraties zijn een volumetrische methode die is gebaseerd op het meten van de hoeveelheid reagens met een bekende concentratie (bekend als een primair standaard) die wordt verbruikt door een monster met onbekende concentratie, bekend als analyte.
De titratie wordt uitgevoerd door het toevoegen van de titrant aan de analyte met behulp van een buret, zodat een chemisch equivalent tussen de titrant en de analyte wordt verkregen. Dit wordt het "equivalentiepunt" genoemd en het is een theoretische waarde die experimenteel niet kan worden bepaald.
De experimentele schatting van dit punt wordt verkregen via een benadering die bekend staat als het "eindpunt". Dit wordt bepaald door een fysieke verandering. In dat geval wordt de kleurverandering van de oplossing bereikt na het toevoegen van een indicatorstof: een stof die van kleur verandert binnen bepaalde pH-waardes.
Voor de zuur-base titratie gebruiken we een fenolftaleïne-indicator die lichtroze wordt na een pH van ongeveer 8,4, wat een waarde is die zeer dicht bij het equivalentiepunt ligt in de meest voorkomende zuur-base titraties.
Alternatief kan in de potentiometrische configuratie een digitale pH-sensor worden gebruikt om het "equivalentiepunt" te bepalen.
Colorimetrische vs Potentiometrische benadering
De colorimetrische benadering vertrouwt op de kleurverandering die wordt geleverd door de fenolftaleïne-indicator. De potentiometrische benadering vertrouwt in plaats daarvan op de pH-stijging die wordt gemeten door de digitale sensor. In deze versie van het laboratorium zijn er twee verschillende configuraties beschikbaar, één voor elke aanpak. In de colorimetrische configuratie kunnen studenten de digitale pH-sensor niet zien.
Verschillen met het Zuur-Base Titratie II-laboratorium
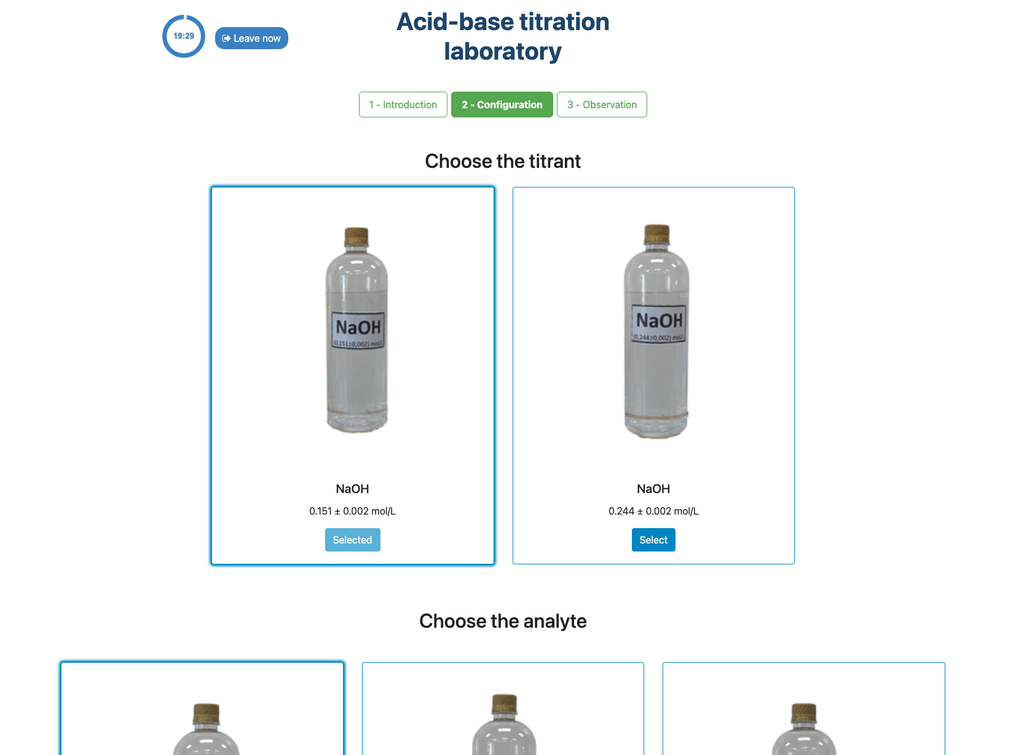
In deze versie van het laboratorium (Zuur-Base Titratie II) kun je de zuur-base titratie uitvoeren voor een onbekende azijnzuuroplossing. In de andere versie van het laboratorium (zie Zuur-Base Titratie I) kun je de zuur-base titratie uitvoeren voor een citroenzuuroplossing.
Deze versie van het laboratorium legt de nadruk op visuele buretmetingen, inclusief het correct aflezen van de meniscus in de buret. De andere versie van het laboratorium (zie Zuur-Base Titratie I) legt hier geen nadruk op en richt zich in plaats daarvan op de berekeningen.
Ook kun je in deze versie kiezen tussen twee verschillende configuraties: één voor de potentiometrische aanpak en één voor de colorimetrische aanpak. De configuratie voor de colorimetrische aanpak toont de pH-sensor niet. In de andere versie van het laboratorium (zie Zuur-Base Titratie I) is er één enkele configuratie en wordt de sensor altijd getoond.
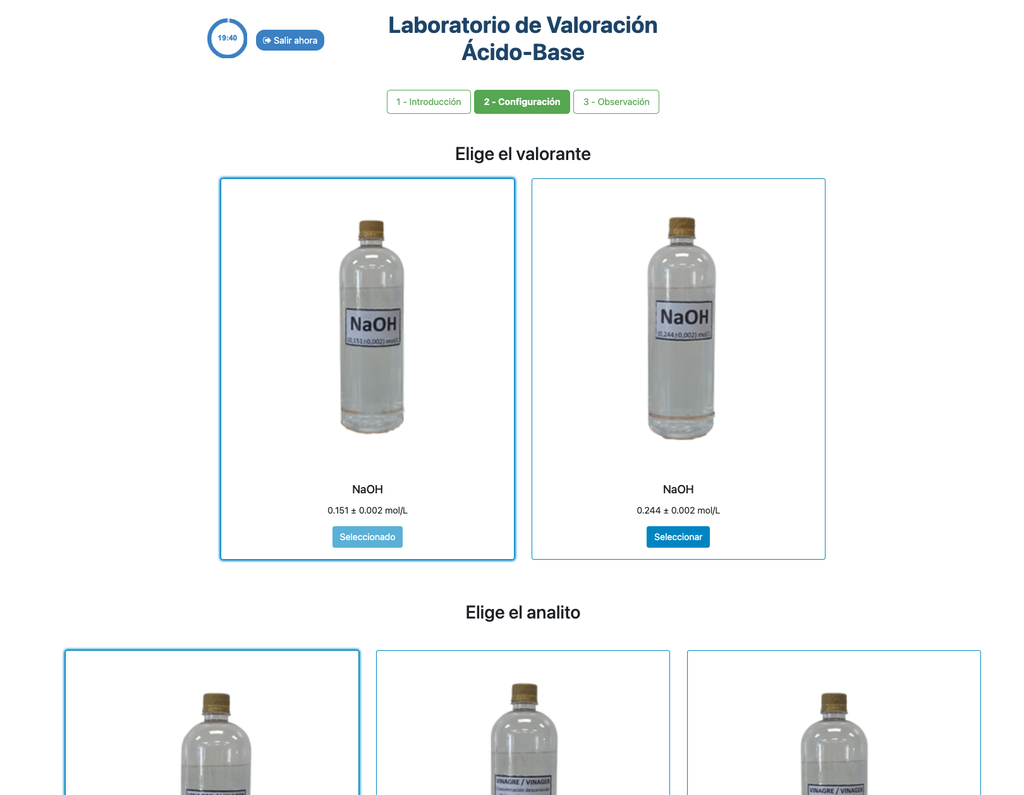
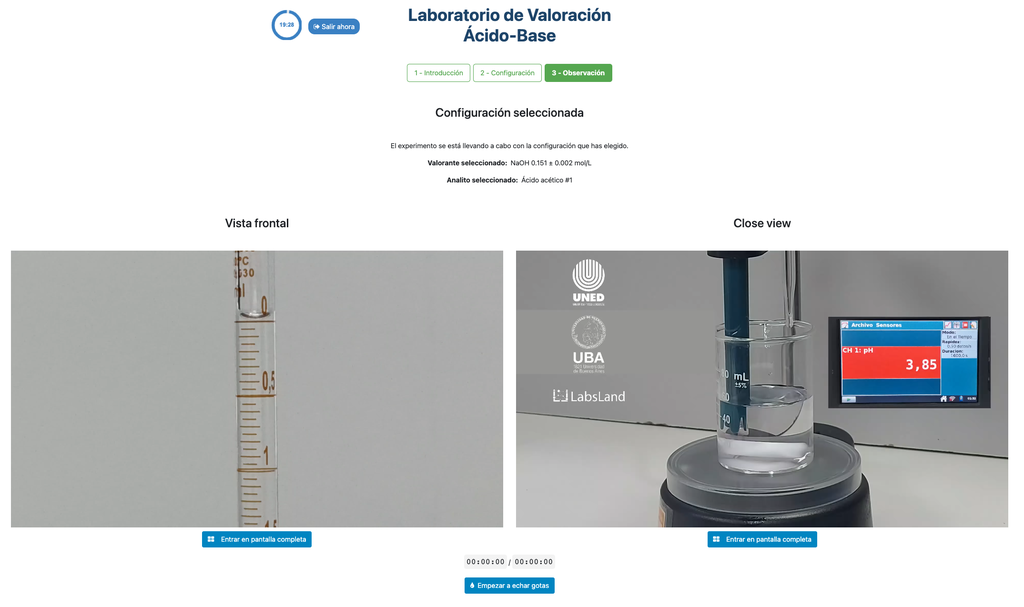
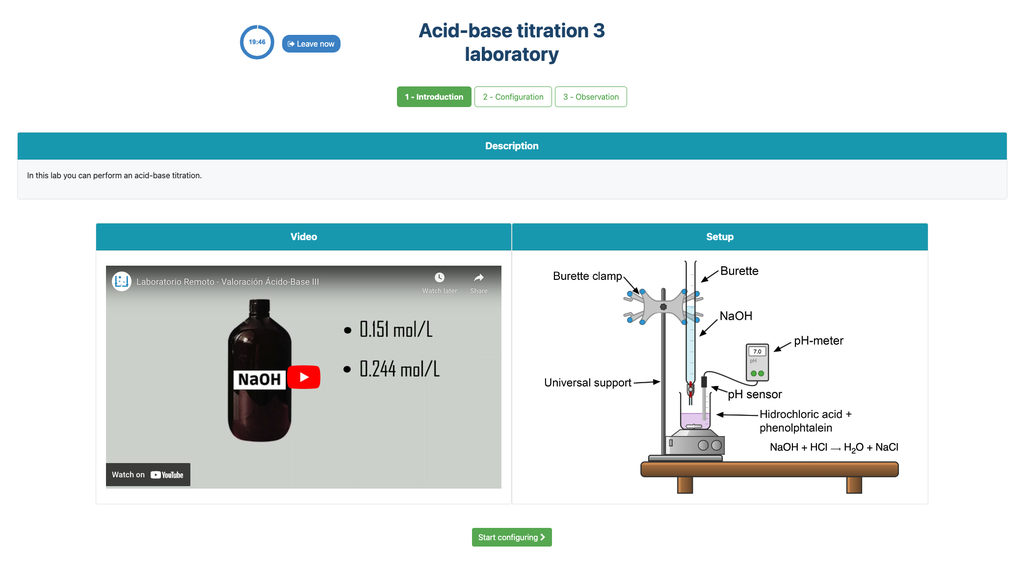
Zuur-base titratie III
Samenvatting
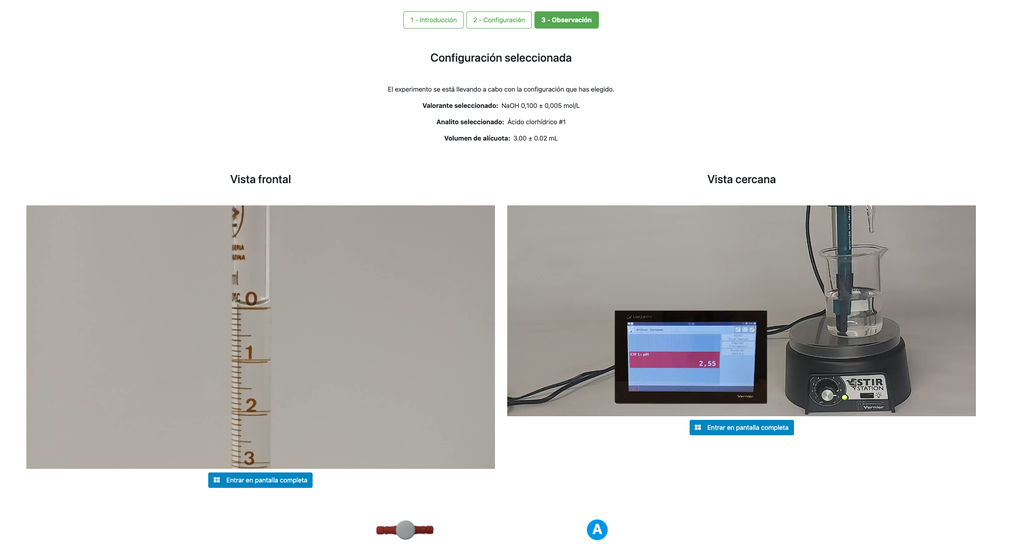
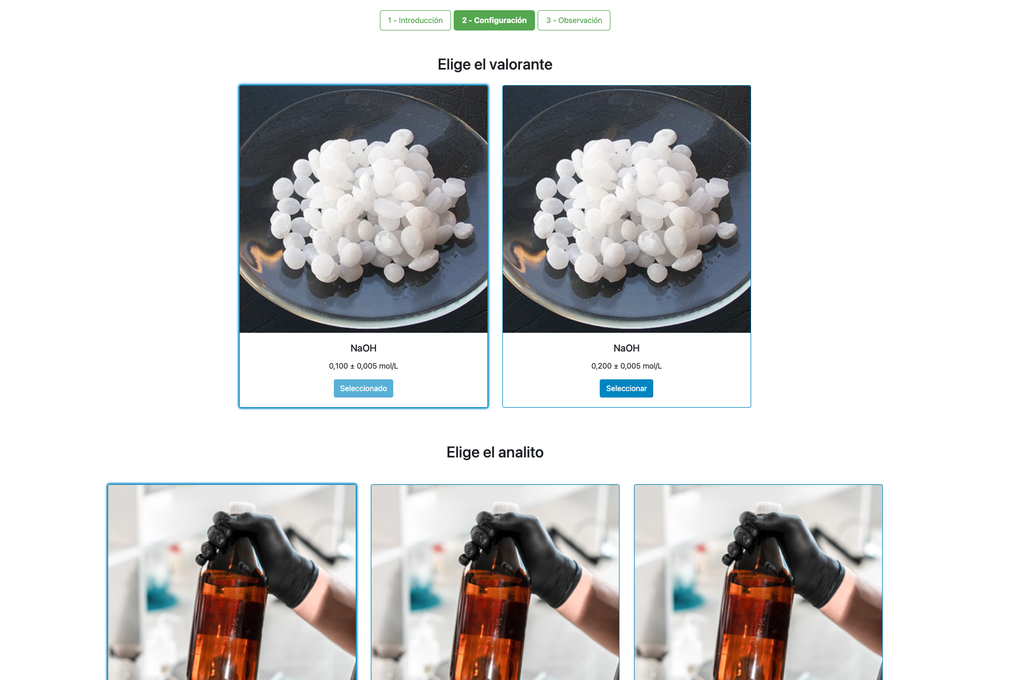
Voer een zuur-base titratie uit om de concentratie van een onbekende zoutzuur oplossing te bepalen met behulp van een natriumhydroxide titrant. Dit laboratorium legt de nadruk op visuele metingen met betrekking tot de meniscus van de buret, en ondersteunt twee verschillende configuraties.
De eerste is voor een potentiometrische benadering: je hebt toegang tot een digitale pH-sensor en je kunt deze gebruiken om vast te stellen wanneer de onbekende oplossing geneutraliseerd is.
De tweede is voor een colorimetrische benadering: je kunt vertrouwen op de kleurverandering als gevolg van de aanwezigheid van een fenolphthaleïne-indicator, zonder beschikbaarheid van een digitale pH-sensor.
Zuur-base titratie
Titraties zijn een volumetrische methode die gebaseerd is op het meten van de hoeveelheid van een reactief met bekende concentratie (bekend als een primaire standaard) dat wordt verbruikt door een onbekende concentratie monster bekend als analyte.
De titratie wordt uitgevoerd door het toevoegen van de titrant aan de analyte met behulp van een buret, om zo een chemisch gelijkwaardige stof te verkrijgen tussen de titrant en de analyte. Dit staat bekend als het "equivalentie punt" en is een theoretische waarde die niet experimenteel kan worden bepaald.
De experimentele schatting van dit punt wordt verkregen door een benadering die bekend staat als "eindpunt". Dit wordt bepaald door een fysieke verandering. In dat geval wordt de kleurverandering van de oplossing bereikt na het toevoegen van een indicatorstof: een stof die van kleur verandert in bepaalde pH-bereiken.
Voor de zuur-base titratie gebruiken we een fenolphthaleïne-indicator die lichtroze wordt na een pH van ongeveer 8,4, een waarde die zeer dicht bij het equivalentiepunt ligt in de meest voorkomende zuur-base titraties.
Als alternatief kan in de potentiometrische configuratie een digitale pH-sensor worden gebruikt om het "equivalentiepunt" te bepalen.
Colorimetrische versus Potentiometrische benadering
De colorimetrische benadering maakt gebruik van de kleurverandering die door de fenolphthaleïne-indicator wordt veroorzaakt. In plaats daarvan vertrouwt de potentiometrische benadering op de pH-verandering zoals gemeten door de digitale sensor. In deze versie van het laboratorium zijn er twee verschillende configuraties beschikbaar, één voor elke benadering. In de colorimetrische configuratie kunnen studenten de digitale pH-sensor mogelijk niet zien.
Verschillen met de andere titratielaboratoria
In deze versie van het laboratorium (Zuur-Base Titratie II) kun je de zuur-base titratie uitvoeren voor een onbekende zoutzuur oplossing. In andere versies van het laboratorium kun je de zuur-base titratie uitvoeren voor een citroenzuur oplossing (Zuur-Base Titratie I) en azijnzuur (Zuur-Base Titratie II).
Zowel deze versie van het laboratorium (Zuur-Base Titratie III) als Zuur-Base Titratie II leggen de nadruk op visuele buretmetingen, waaronder het correct aflezen van de meniscus in de buret. De andere versie van het laboratorium (zie Zuur-Base Titratie I) legt hierop de nadruk niet, maar richt zich in plaats daarvan op de berekeningen.
Bovendien, in deze versies kun je kiezen tussen twee verschillende configuraties: één voor de potentiometrische benadering en één voor de colorimetrische benadering. De configuratie voor de colorimetrische benadering toont de pH-sensor niet. In andere versie van het laboratorium (zie Zuur-Base Titratie I) is er een enkele configuratie en wordt de sensor altijd getoond.
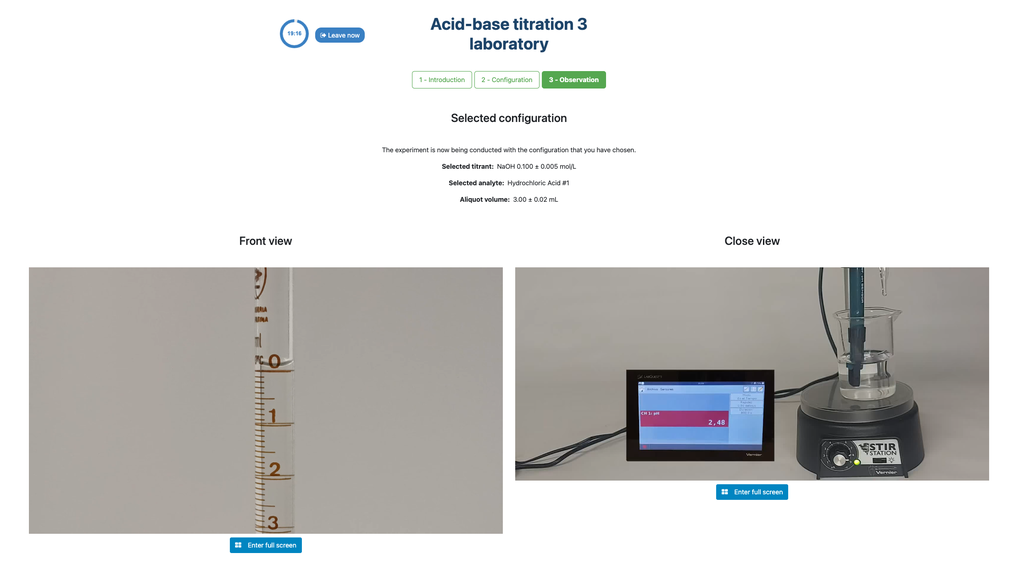
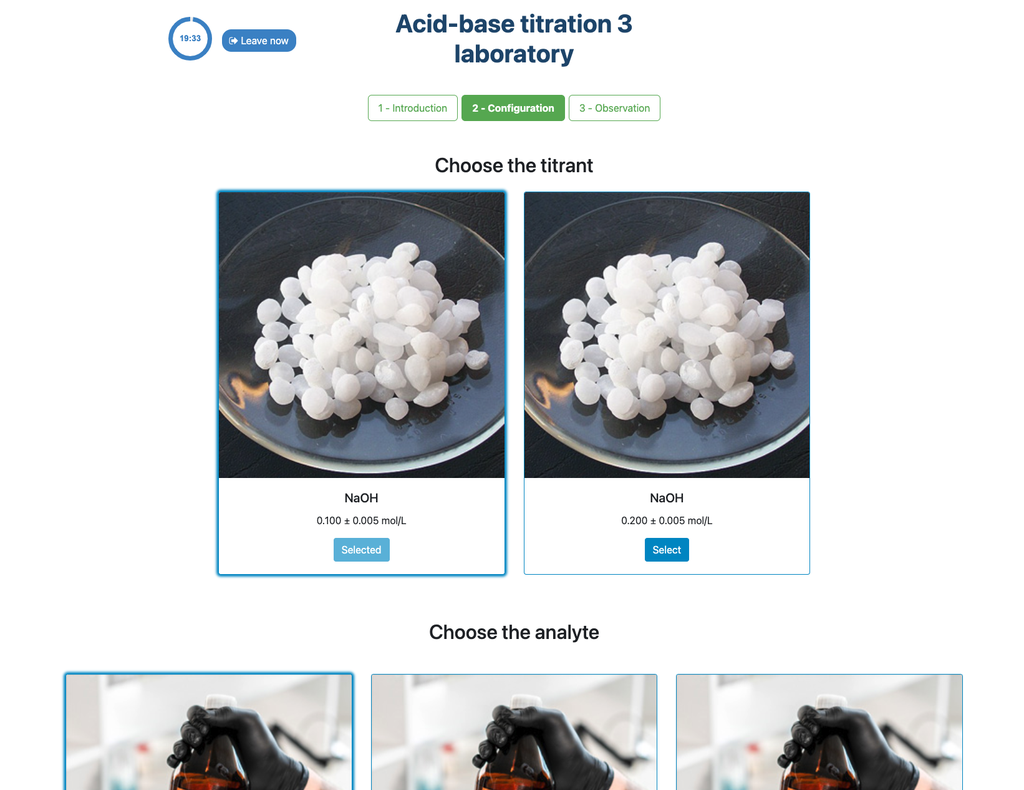

Zuur-Base Titratie I
Samenvatting
Voer een zuur-base titratie uit om de concentratie van een onbekende citroenzuuroplossing te bepalen met behulp van een natriumhydroxide titrant. Een digitale pH-sensor is altijd beschikbaar en een fenolftaleïne-indicator is toegevoegd aan de onbekende oplossing zodat zowel een potentiometrische als colorimetrische benadering kan worden gebruikt. Een realtime plot is ook beschikbaar.
\u00a0
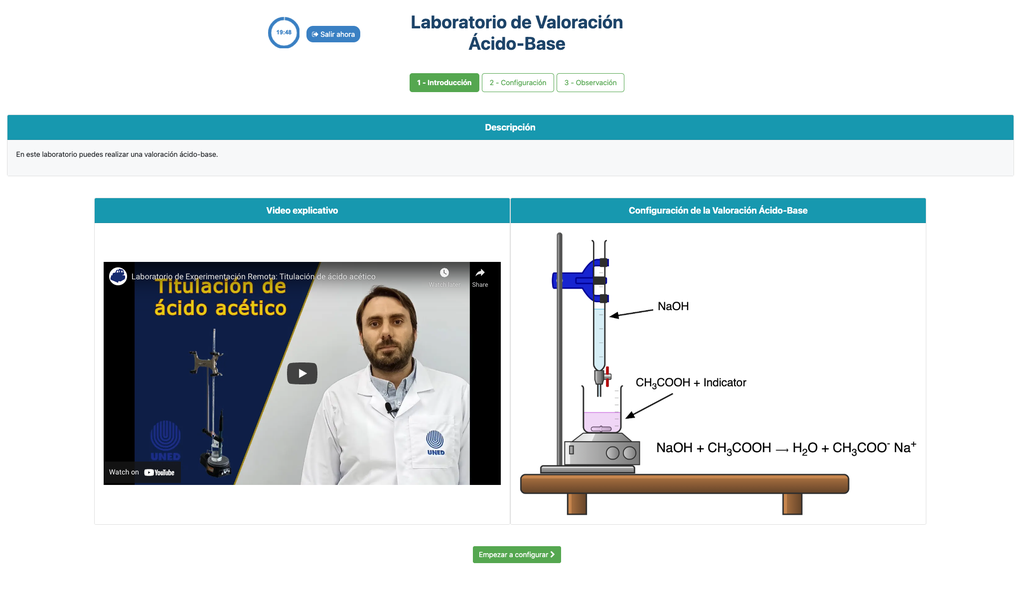
Zuur-Base Titratie
Titraties zijn een volumetrische methode die is gebaseerd op het meten van de hoeveelheid van een reactief met bekende concentratie (bekend als een primaire standaard) dat wordt verbruikt door een monster met onbekende concentratie, ook wel analyte genoemd.
De titratie wordt uitgevoerd door het toevoegen van de titrant aan de analyte met behulp van een buret, zodat een chemisch equivalent ontstaat tussen de titrant en de analyte. Dit staat bekend als het "equivalentiepunt" en is een theoretische waarde die experimenteel niet kan worden bepaald.
De experimentele schatting van dit punt wordt verkregen via een benadering bekend als "eindpunt". Dit wordt bepaald door een fysieke verandering. In dat geval wordt de kleurverandering van de oplossing bereikt na toevoeging van een indicatorstof: een stof die van kleur verandert in bepaalde pH-bereiken.
Voor de zuur-base titratie gebruiken we een fenolftaleïne-indicator die lichtroze wordt na een pH van ongeveer 8,4, wat een waarde is die zeer dicht bij het equivalentiepunt ligt in de meest voorkomende zuur-base titraties.
\u00a0
Colorimetrische vs Potentiometrische benaderingen
De colorimetrische benadering is gebaseerd op de kleurverandering die wordt verschaft door de fenolftaleïne-indicator. De potentiometrische benadering daarentegen is gebaseerd op de pH-stijging zoals gemeten door de digitale sensor. In deze versie van het zuur-base titratie laboratorium kunnen beide benaderingen worden gebruikt. De digitale sensor is altijd beschikbaar en kan niet worden verborgen.
\u00a0
Verschillen met het Zuur-Base Titratie II laboratorium
In deze versie van het laboratorium (Zuur-Base Titratie I) kun je de zuur-base titratie uitvoeren voor een onbekende citroenzuuroplossing. In de andere versie van het laboratorium (zie Zuur-Base Titratie II) kun je de zuur-base titratie uitvoeren voor een azijnzuuroplossing in plaats daarvan. \u00a0
Deze versie van het laboratorium benadrukt de berekeningen maar heeft visuele buretmetingen niet als leerdoelen. De andere versie van het laboratorium (zie Zuur-Base Titratie II) legt de nadruk op visuele metingen, en studenten moeten leren hoe ze de meniscus van de buret correct kunnen aflezen.
Bovendien is er in deze versie een enkele ervaring die kan worden gebruikt voor zowel de colorimetrische als potentiometrische benaderingen. In de andere versie van het laboratorium (zie Zuur-Base Titratie II) zijn er twee verschillende configuraties beschikbaar, waarvan in één de digitale sensor verborgen is, zodat studenten alleen kunnen vertrouwen op de kleurverandering.
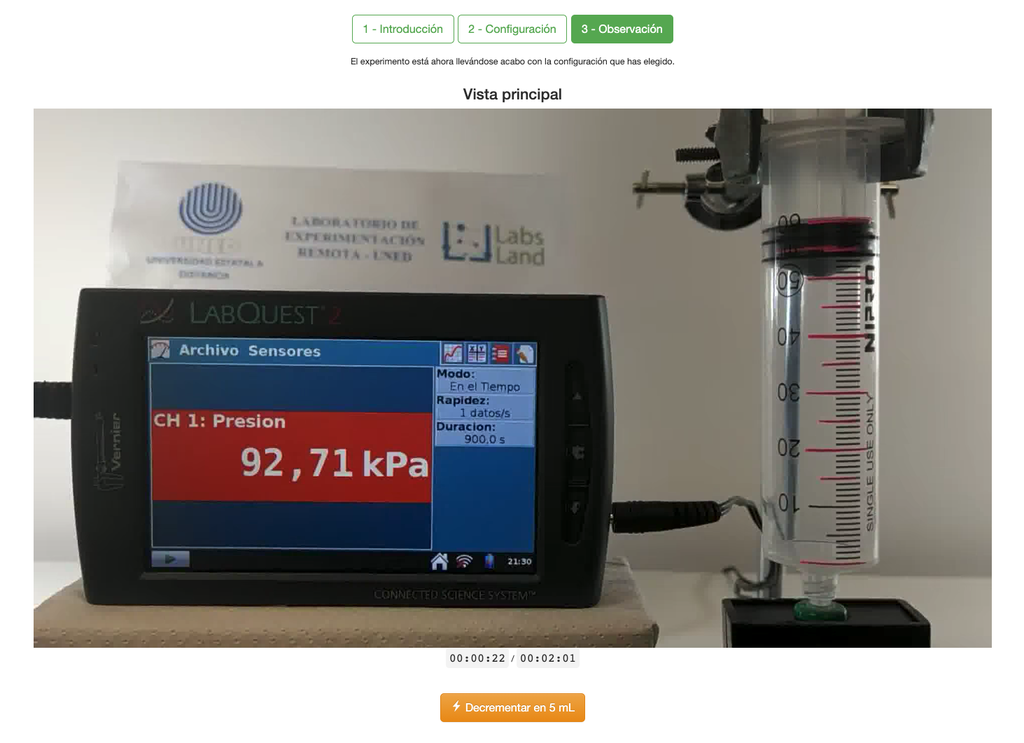
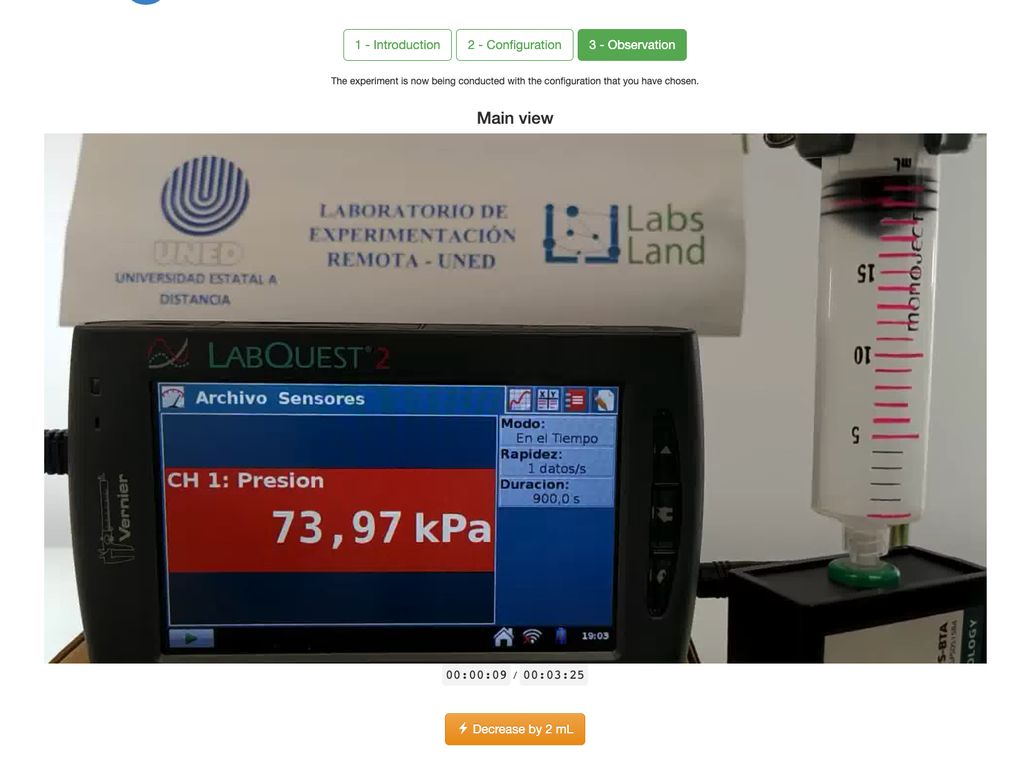
De wet van Boyle
Samenvatting
Het Boyle's Law laboratorium stelt studenten in staat om de relatie tussen de druk en het volume van een gas bij kamertemperatuur en constante temperatuur te bepalen. Studenten kunnen kiezen uit twee verschillende volume spuiten en de druk van het gas meten terwijl ze het volume verminderen. Het experiment wordt weerspiegeld in een grafische analyse in de vorm van een isotherm. Op deze manier kunnen ze Boyle's Law verifiëren en leren over het gedrag van gassen op een praktische en toegankelijke manier.
Boyle's Wet
Boyle's Wet stelt dat bij een constante temperatuur het volume van een gas omgekeerd evenredig is aan de druk ervan. Dit betekent dat als de druk van een gas toeneemt, het volume afneemt, en vice versa. Boyle's Wet kan wiskundig worden uitgedrukt als:
V 1/P
Waar V het volume van het gas is en P de druk van het gas is.
Het Boyle's Law laboratorium stelt studenten in staat om deze wet in praktijk te brengen en te verifiëren in een experimentele context. Door het volume en de druk van het gas op verschillende momenten te meten, kunnen ze een isotherm grafiek plotten die laat zien hoe het volume van het gas verandert op basis van de druk ervan. Als de isotherm grafiek past bij Boyle's Wet, dan hebben de studenten de wet experimenteel geverifieerd.
Het uitvoeren van experimenten zoals dit is een uitstekende manier om meer te leren over het gedrag van gassen en hoe verschillende variabelen met elkaar in verband staan. Bovendien kunnen praktische experimenten toegankelijker en memorabeler zijn voor studenten dan alleen maar over de wet lezen in een handboek. De isotherm grafiek visualiseert duidelijk het gedrag van het gas en verifieert of de voorspellingen van Boyle's Wet worden nageleefd.
Toepassing in Middelbaar en Universitair Onderwijs
Het Boyle's Wet laboratorium wordt doorgaans toegepast in natuurkundevakken op middelbaar niveau en in scheikunde vakken op universitair niveau. Op het middelbaar niveau kan het laboratorium worden toegepast in een natuurkunde les waarin de basisconcepten van scheikunde en fysica, zoals de druk en het volume van gassen, worden bestudeerd. Op de universiteit kan het Boyle's Wet laboratorium worden toegepast in een meer gevorderde scheikundeles waarin de studie van gassen en hun gedrag wordt uitgediept.
Doelstellingen
Een Boyle's Wet laboratorium kan verschillende educatieve doelstellingen hebben, afhankelijk van het opleidingsniveau waarop het wordt toegepast. Hieronder volgen enkele voorbeelden van doelstellingen die een Boyle's Wet laboratorium kan hebben op zowel middelbaar als universitair niveau:
Op middelbaar niveau:
- Studenten begrijpen Boyle's Wet en het belang ervan in de gasfysica.
- Studenten oefenen experimentele en observatievaardigheden.
- Studenten ontwikkelen vaardigheden in gegevensanalyse en representatie.
- Studenten begrijpen de relatie tussen temperatuur, druk en volume van gassen.
Op universitair niveau:
- Studenten kennen Boyle's Wet en het belang ervan in de gasfysica.
- Studenten demonstreren experimentele en observatievaardigheden in het laboratorium.
- Studenten passen theoretische concepten van gasfysica toe in praktische situaties.
- Studenten ontwikkelen vaardigheden in gegevensanalyse en representatie in een wetenschappelijke context.
- Studenten begrijpen hoe temperatuur, druk en volume van gassen met elkaar in verband staan in verschillende situaties.
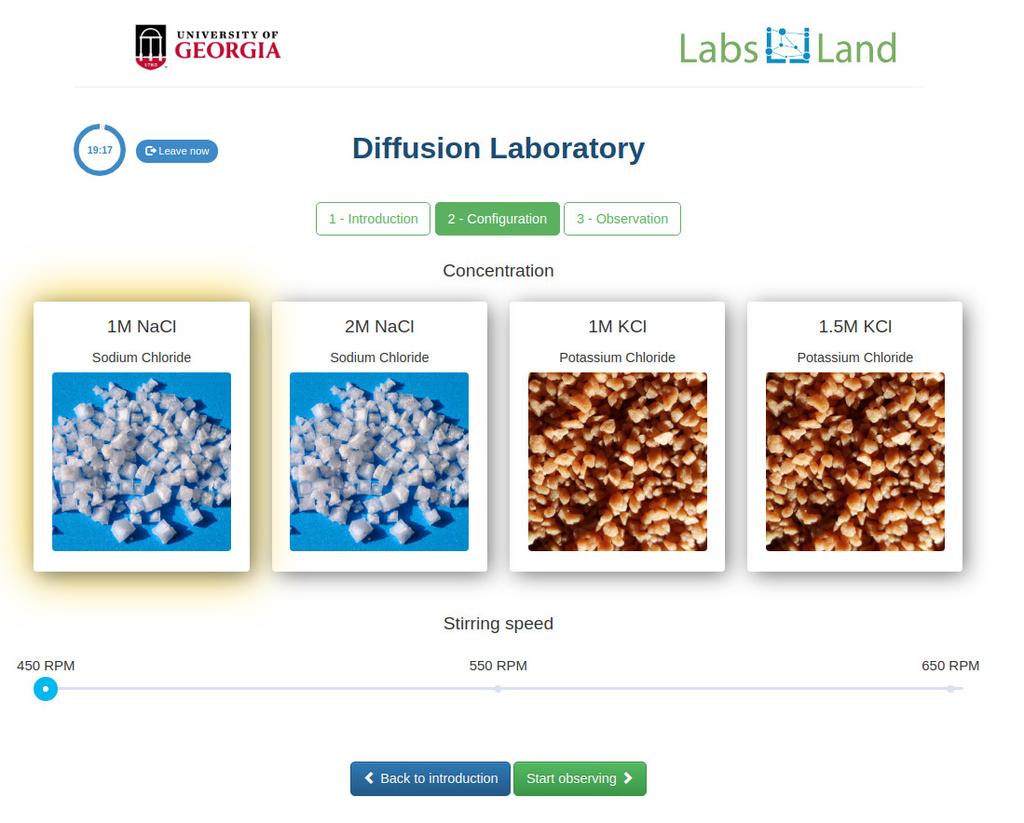
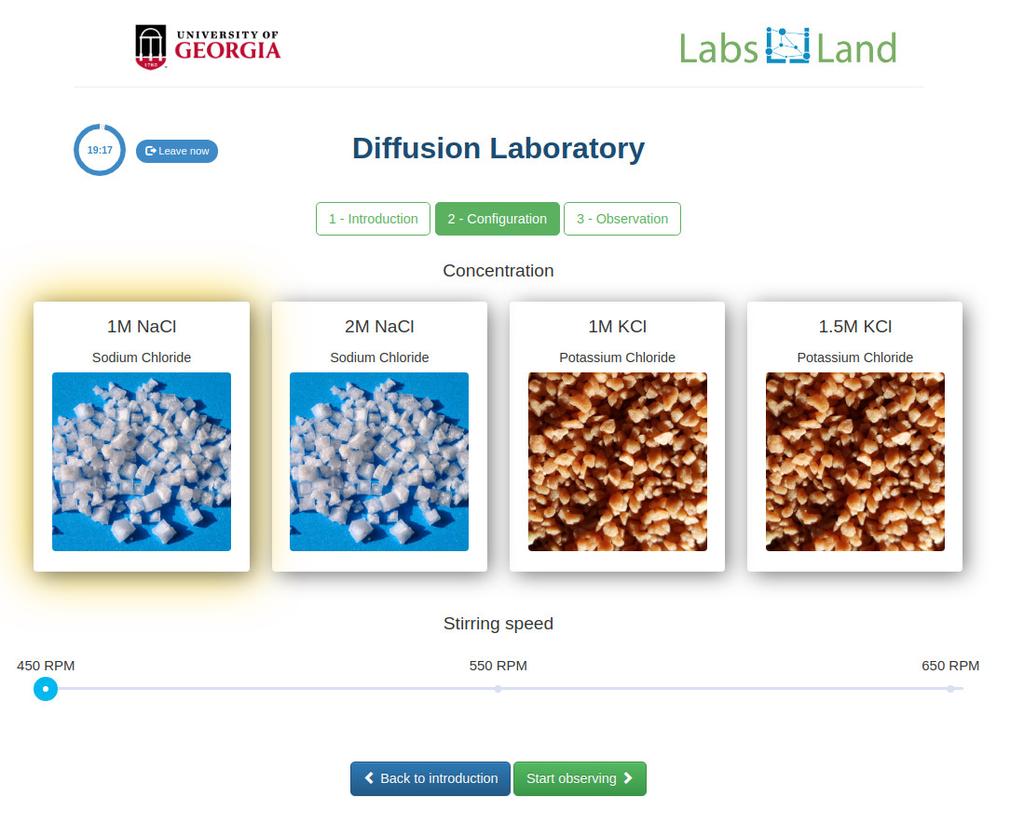
Diffusion laboratory - basic
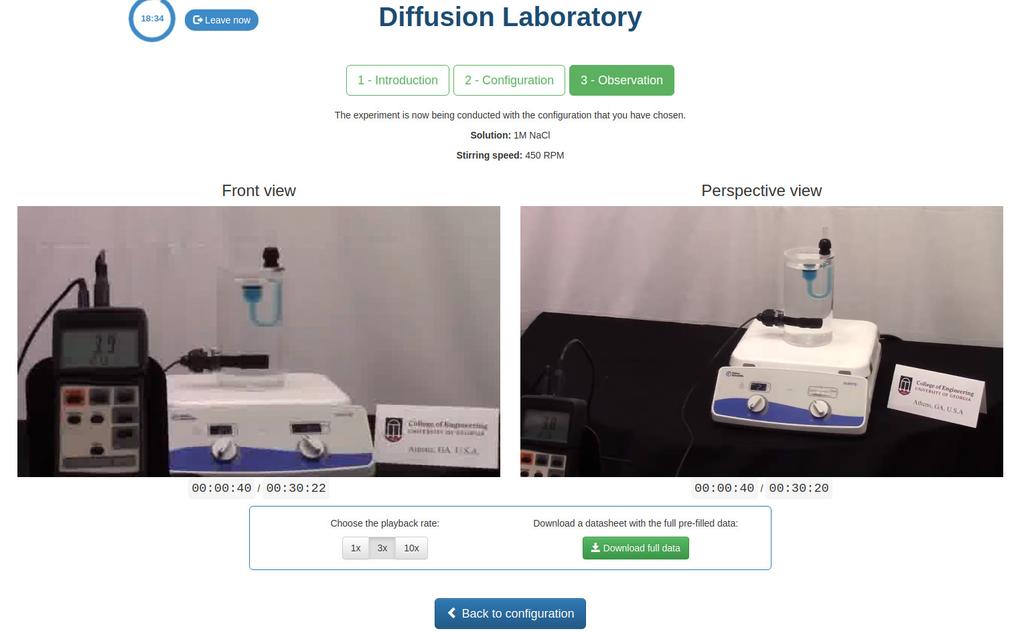
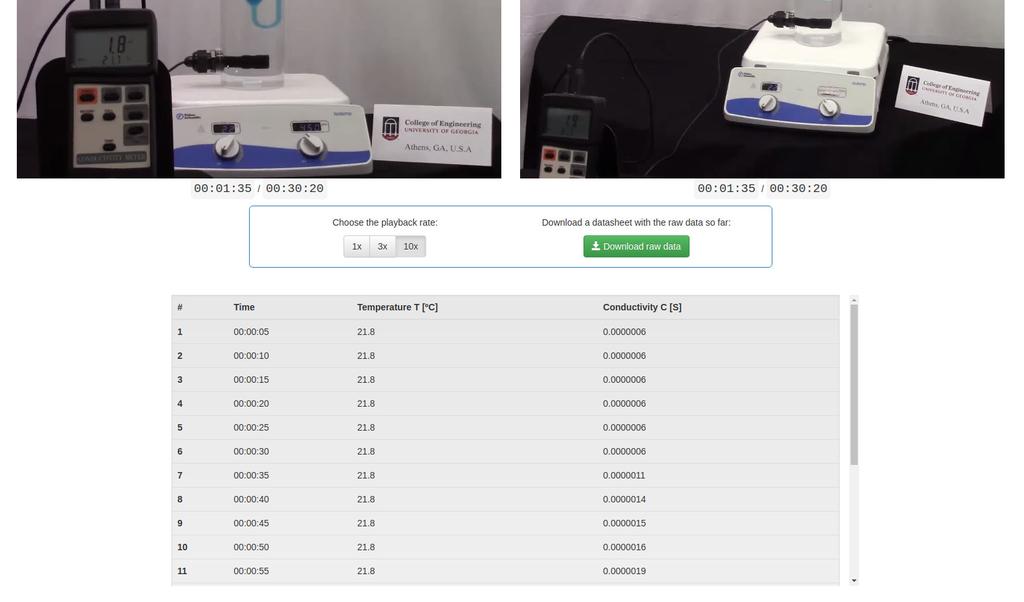
Diffusion laboratory - data
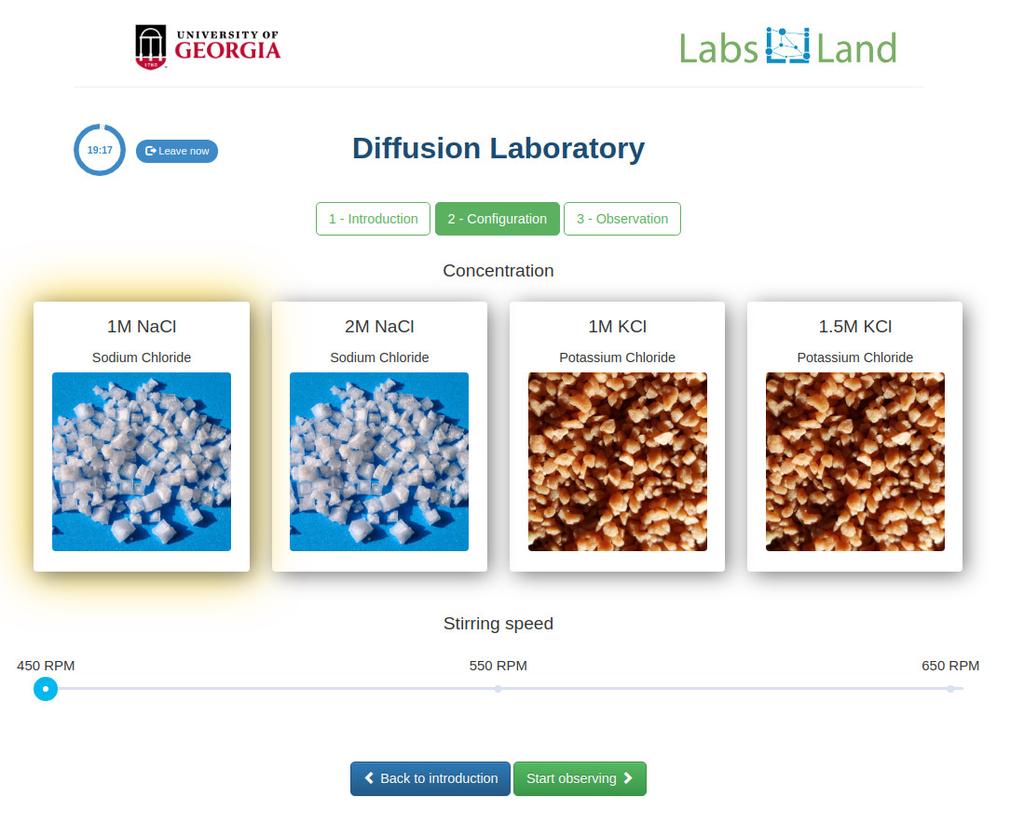
Diffusion laboratory - full
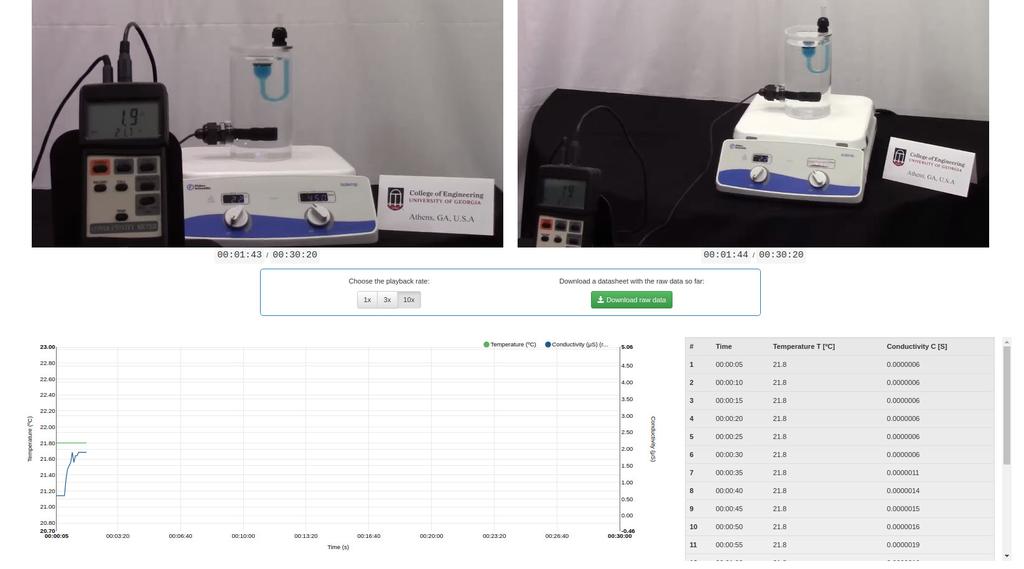
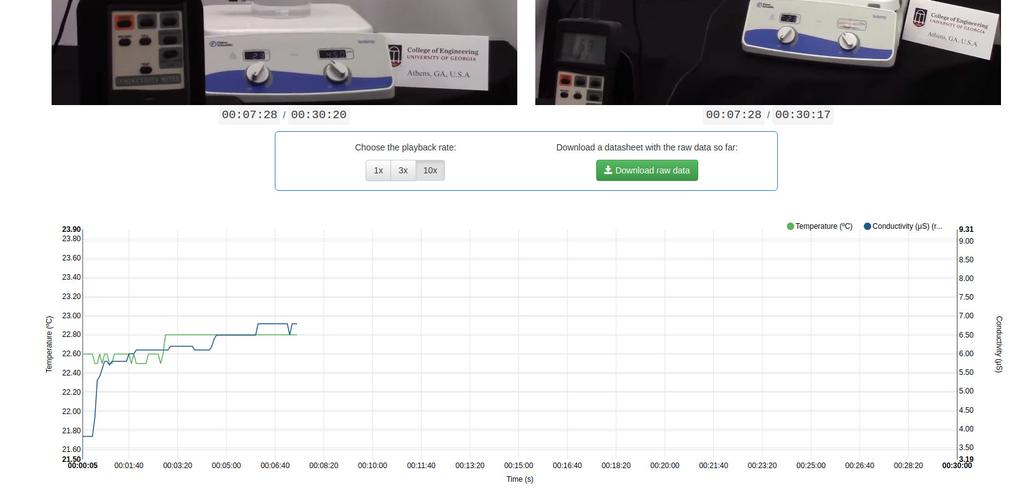
Diffusion laboratory - plot
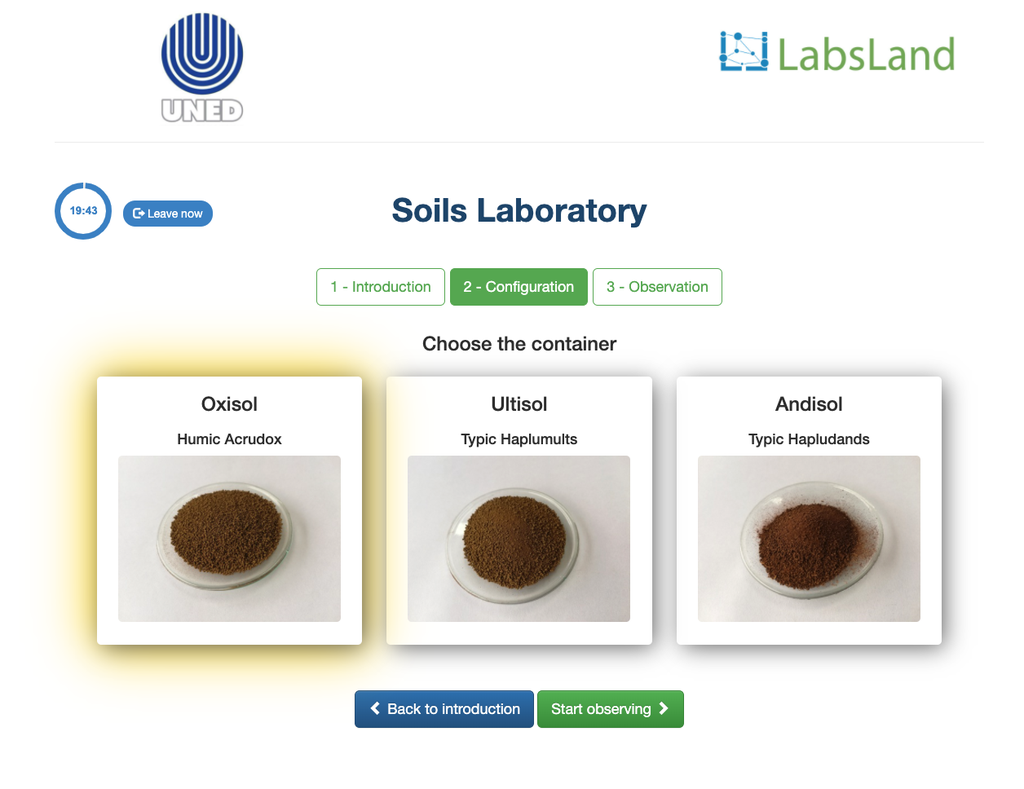
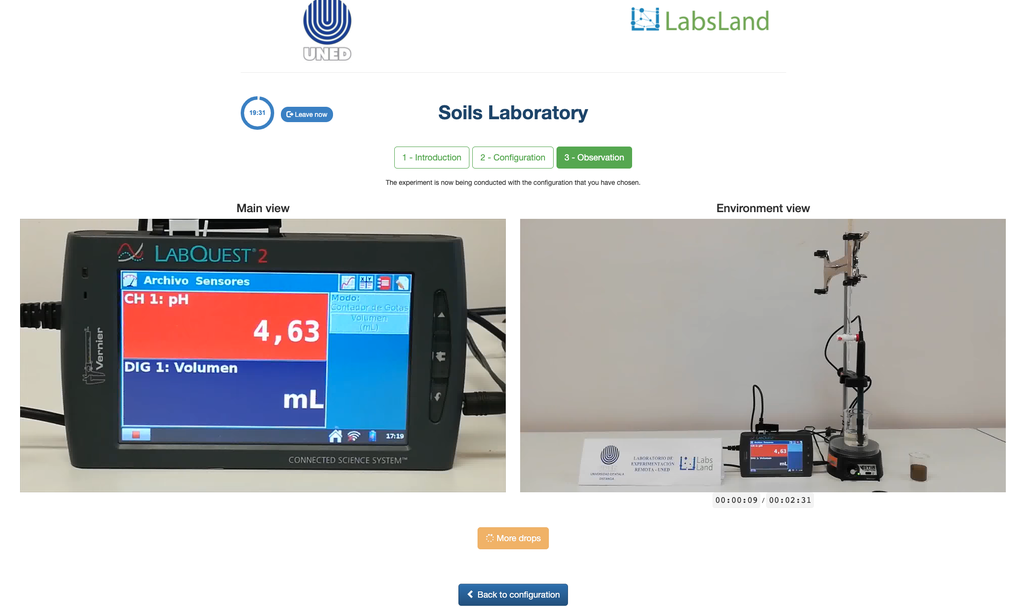
Uitwisselbare zuurgraad van bodems
De zuurgraad van bodem kan optreden door verschillende processen die een pH-vermindering bevorderen. Deze processen komen natuurlijk voor of door menselijk handelen. De belangrijkste bronnen van bodemzuurgraad zijn verbonden met waterstofionen (H+) en aluminiumionen (Al+3) in de bodemoplossing. Verwisselbare zuurgraad wordt bepaald door het gebruik van neutrale zoutoplossingen zoals kaliumchloride (KCl). De zure ionen (aluminium en hydronium) die vastgehouden worden in de colloïdale fractie van de bodem, maken dat die in de aanwezigheid van een verdringingsion (K+) in de bodemoplossing terechtkomen. Vervolgens wordt die oplossing getitreerd met een natriumhydroxide-oplossing van exacte concentratie om het laatste punt van de neutralisatiereactie te bereiken met behulp van fenolftaleïne als indicator.

De wet van Gay-Lussac
De wet van Gay-Lussac stelt ons in staat het gedrag van gassen te bestuderen en wordt vaak bestudeerd in de natuurkunde en scheikunde. Het relateert de druk van een gas met zijn temperatuur, terwijl andere parameters zoals volume en hoeveelheid constant blijven.
Er zijn verschillende manieren om de wet van Gay-Lussac te verifiëren. In dit experiment zullen we verifiëren dat, voor een gegeven hoeveelheid gas, de druk recht evenredig is met de temperatuur.
Radioactiviteit
Samenvatting
De opstelling, nuttig voor scholen en universiteiten, omvat een Geigerteller die het aantal gedetecteerde deeltjesbotsingen kan meten. De gebruiker kan kiezen uit verschillende radioactieve bronnen en een absorber om tussen de radioactieve bron en de sonde te plaatsen. Daarnaast kunnen andere parameters die gebruikers kunnen variëren de afstand en het aantal tests zijn. Dit biedt een breed scala aan experimenten en leermogelijkheden.
Radioactiviteit
Radioactiviteit is het proces waarbij een atoomkern energie verliest door deeltjes en straling uit te zenden. Dit kan van nature voorkomen in bepaalde elementen, of kunstmatig door het gebruik van nucleaire reacties. In de context van natuurkunde op scholen en universiteiten kan het bestuderen van radioactiviteit waardevolle inzichten geven in de fundamentele aard van materie en de natuurwetten.
Een veelvoorkomend experiment in dit gebied is de meting van radioactiviteit met een Geigerteller. Dit instrument kan de emissie van deeltjes van een radioactieve bron detecteren, zodat studenten de basisprincipes van straling en de effecten ervan op materie kunnen begrijpen. Door het type radioactieve bron, de afstand tussen de bron en de detector, en het type absorbermateriaal dat tussen de twee wordt geplaatst te variëren, kunnen studenten een breed scala aan fenomenen verkennen en een dieper begrip krijgen van de onderliggende principes.
Naast de educatieve waarde ervan heeft het bestuderen van radioactiviteit ook praktische toepassingen op gebieden zoals geneeskunde, energieproductie en milieubescherming. Het is daarom een belangrijk onderwerp voor studenten om over te leren, zowel vanwege het intrinsieke belang ervan als vanwege de vele toepassingen in de echte wereld.
Toepassingen van radioactiviteit in de echte wereld
Een van de meest voorkomende toepassingen van radioactiviteit is binnen het veld van de geneeskunde. Radioactieve isotopen worden gebruikt in medische beeldvormingstechnieken zoals PET- en SPECT-scans, waarmee artsen binnen in het lichaam kunnen kijken en ziekten kunnen diagnosticeren. Radioactieve isotopen worden ook gebruikt bij kankerbehandelingen, zoals radiotherapie, waarbij ze worden gebruikt om kankercellen te doden.
Radioactiviteit wordt ook gebruikt in industrieën zoals olie- en gasexploratie, waarbij het wordt gebruikt om de doorlaatbaarheid van rotsformaties en de stroming van vloeistoffen door hen te meten. Radioactieve isotopen worden ook gebruikt in rookdetectoren en in de productie van lichtgevende horloges en instrumenten.
Over het geheel genomen heeft radioactiviteit een breed scala aan toepassingen in velden zoals geneeskunde, industrie en zelfs alledaagse consumentproducten. Het blijft een belangrijk studiegebied in de natuurkunde en andere wetenschappen, en het gebruik ervan blijft uitbreiden naarmate nieuwe technologieën worden ontwikkeld.
Radioactiviteitsproeven op scholen en universiteiten
Het gebruik van een Geigerteller in een radioactiviteitsexperiment biedt een breed scala aan mogelijkheden. Door de stralingsbronnen en absorbers te variëren, kunnen studenten de effecten van verschillende bronnen en materialen op de gedetecteerde deeltjesbotsingen observeren. Dit kan studenten helpen de eigenschappen van radioactiviteit en het gedrag van verschillende deeltjes te begrijpen.
Bovendien kunnen experimenten waarbij het type van het gestraald deeltje wordt vastgesteld worden uitgevoerd door te observeren of het deeltje wordt geabsorbeerd of niet. Door verschillende absorbers tussen de bron en de sonde te plaatsen, kunnen studenten de eigenschappen van de uitgezonden deeltjes vaststellen en een dieper begrip krijgen van radioactiviteit.
Ten slotte kunnen experimenten waarbij de geometrische vorm van de radioactieve emissie wordt bepaald ook worden uitgevoerd met een Geigerteller. Door zorgvuldig de gedetecteerde deeltjesbotsingen op verschillende afstanden te meten, kunnen studenten inzicht krijgen in de ruimtelijke verdeling van radioactiviteit. Dit kan studenten helpen de fundamentele principes van radioactiviteit en de toepassingen ervan in de echte wereld te begrijpen.
Potentiële leerdoelen
Potentiële doelen van activiteiten uitgevoerd met het laboratorium zijn de volgende:
- Begrijp de eigenschappen en het gedrag van radioactieve emissies.
- Voer experimenten uit om de effecten van straling op verschillende materialen te meten.
- Bepaal het type straling uitgezonden door een radioactieve bron.
- Begrijp de principes van stralingsveiligheid en -hantering.
- Onderzoek de toepassingen van radioactiviteit in velden zoals geneeskunde, industrie en onderzoek.
- Begrijp de principes van Geigertellers en hun gebruik bij het meten van radioactiviteit.
- Begrijp de historische ontwikkeling van het concept van radioactiviteit en de ontdekking ervan.
- Verken de ethische implicaties van het gebruik van radioactieve materialen.

Spectroscopie
Dit ultraconcurrerende laboratorium is gebaseerd op een experimentele praktijk over röntgenspectroscopie met behulp van een LEYBOLD-apparaat dat is geïnstalleerd in een laboratorium voor radiologische instrumentatie aan de Nationale Universiteit van Costa Rica (Universidad Nacional de Costa Rica), gelegen in het gebouw Toegepaste Medische Fysica.
De opstelling bestaat uit een röntgenbuis met een goud (Au) anode, samen met een scintillatiedetector geconfigureerd met een voorversterker en een digitalisator die het mogelijk maakt om informatie van de metingen van de detector te verwerken via software.
De test heeft als doel om de bundel van de stralingsbron te karakteriseren door de experimentele berekening van het spectrum van de röntgenstraal die in de buis wordt geproduceerd, naast het genereren van basisideeën over radiologische instrumentatie en hoe de variatie van de parameters wordt gebruikt in industriële en medische toepassingen.











