Erhalten Sie jetzt Zugang zu LCAL2003: Chemistry labs (ultraconcurrent)
Für nur:
9,99 $Eine Zahlung
6 Monate Zugang
Unterstützte Zahlungsmethoden:
- DigiKey (Nicht in jedem Land verfügbar)
- Kredit- oder Debitkarte
- PayPal
Sie müssen ein LabsLand-Konto erstellen oder verwenden, um fortzufahren.
Remote-Zugang zu 12 Laboren enthalten:
Versuchen Sie, mehrere Lizenzen für eine Klasse zu kaufen? Kontaktieren Sie uns für Mengenrabatte
Was ist LabsLand?
LabsLand ist das globale Netzwerk von Fernlaboren.
Die Ausrüstung ist immer echt, nicht eine Simulation.
Sie steuern die echte Ausrüstung mit Webcams über das Internet.
Zugriff jetzt. Kein Warten auf eine Lieferung der Ausrüstung notwendig.
Keine versteckten Kosten: alles inbegriffen. Keine Zubehör- oder Versandkosten.
Sehr einfach zu bedienen: Die Ausrüstung funktioniert bereits.
Mieten Sie es nur die Monate, die Sie für Ihr Lernen benötigen.
Wie funktioniert LabsLand?
LabsLand ist ein globales Netzwerk realer Labore, die online verfügbar sind. Schüler (in Schulen, Universitäten und Plattformen für lebenslanges Lernen) können über das Internet auf die echten Labore zugreifen, indem sie ihren Laptop, ihr Tablet oder ihr Telefon verwenden.
Die Labore sind entweder in Echtzeit (Arduino, FPGAs...) zugänglich und befinden sich in verschiedenen Universitäten auf der ganzen Welt. In bestimmten Bereichen (Physik, Biologie, Chemie) sind die Labore LabsLand Ultrakonkurrierende Labore, sodass die Universität alle potenziellen Kombinationen dessen, was im Labor getan werden kann (in einigen Fällen mehrere Tausend), aufgezeichnet hat und interaktiv verfügbar macht.
In jedem Fall ist das Labor immer real (nicht simuliert) und über das Web zugänglich (Sie müssen keine Hardware anschaffen, sich um Versand kümmern usw.).
Sehen Sie sich im folgenden Video an, wie eine typische Benutzersitzung funktioniert:
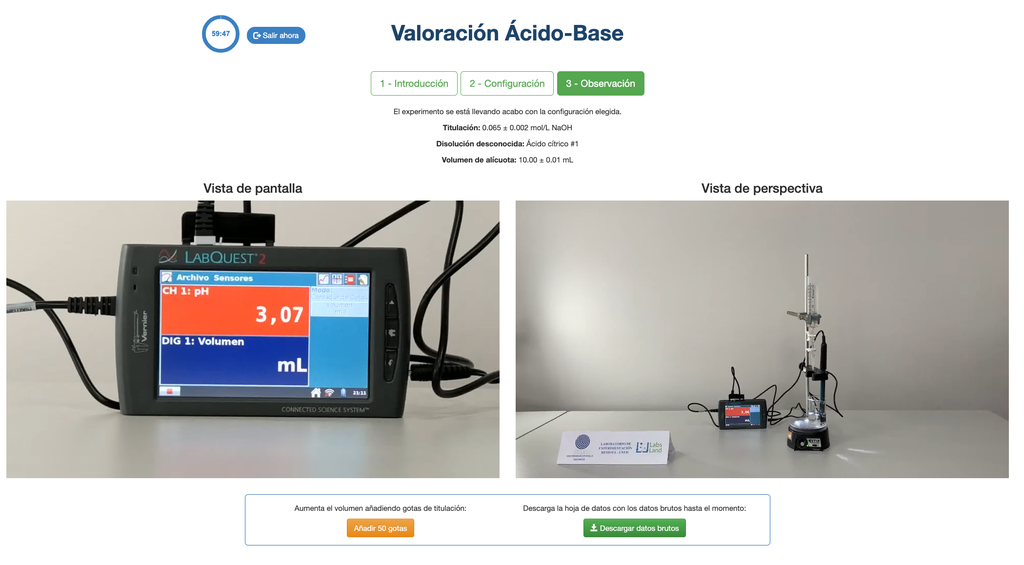
Säure-Base II
Zusammenfassung
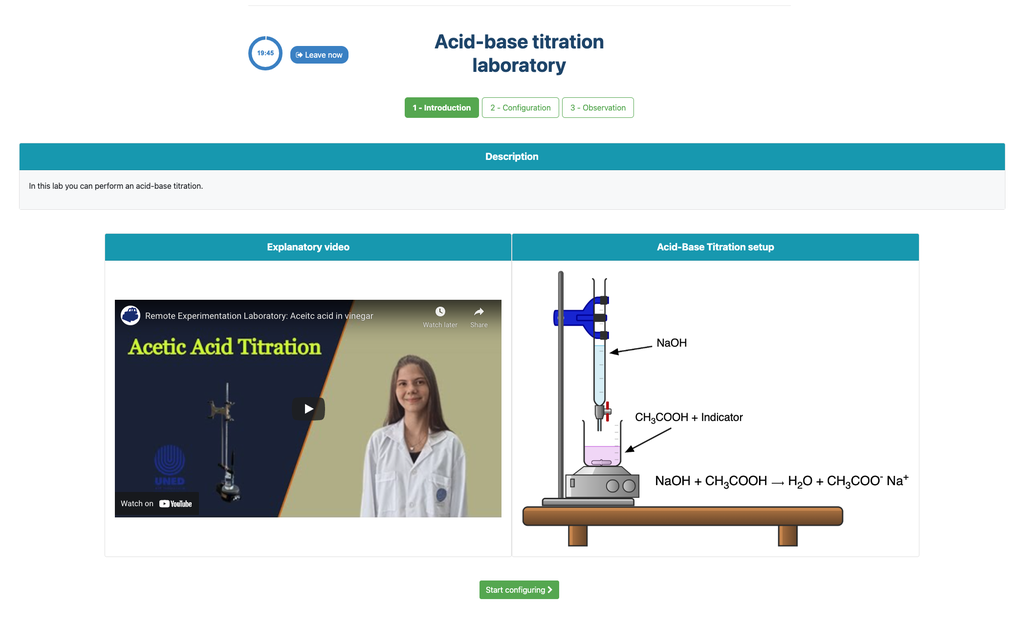
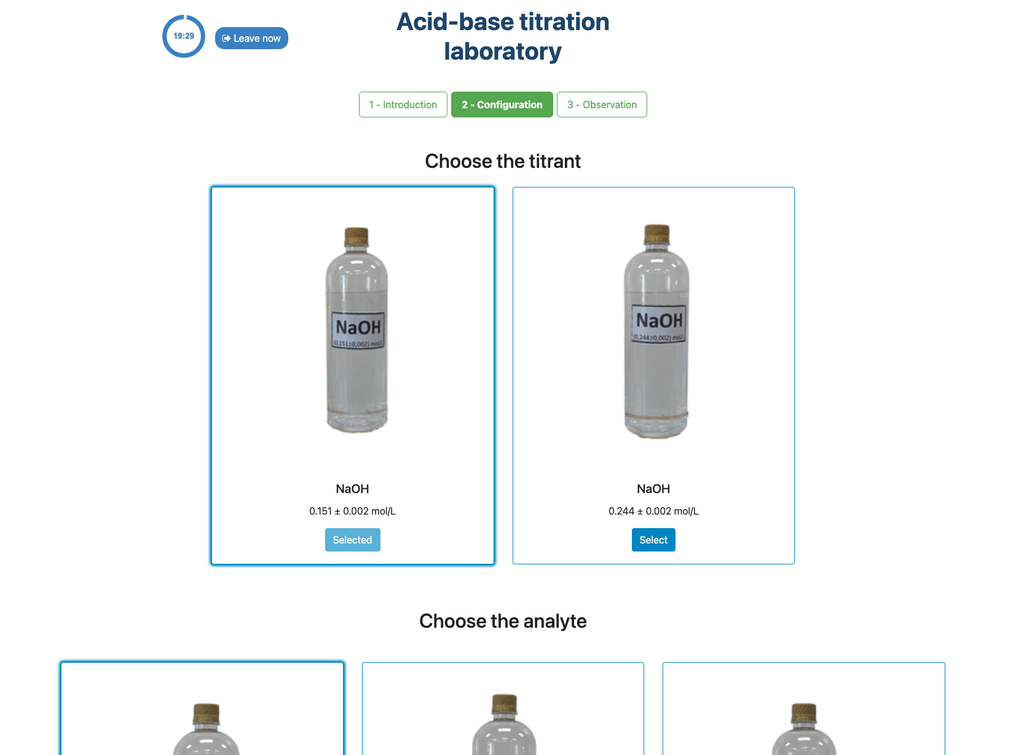
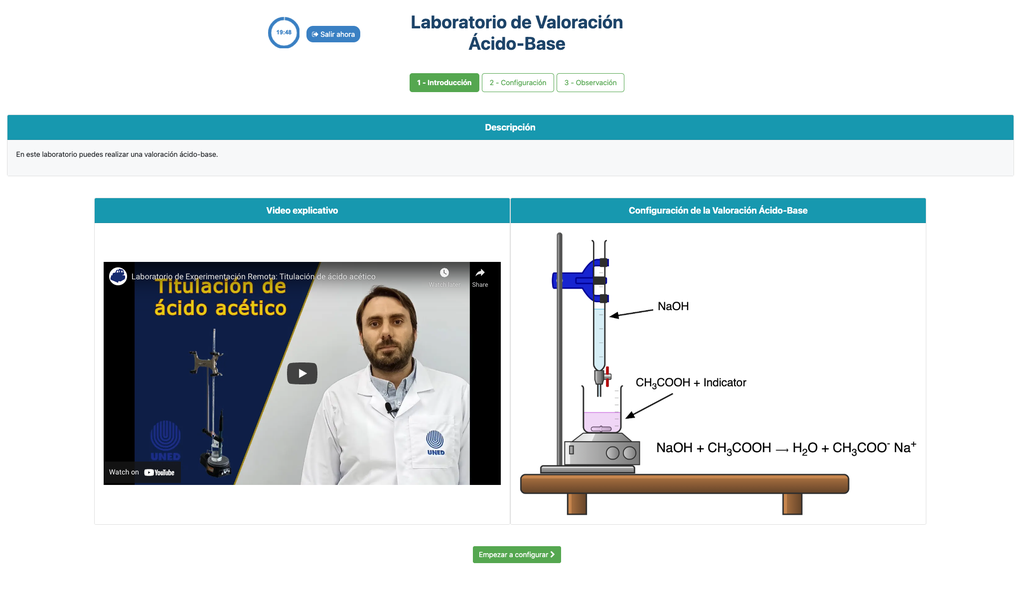
Führen Sie eine Säure-Base-Titration durch, um die Konzentration einer unbekannten Essigsäurelösung mithilfe eines Natriumhydroxid-Titranten zu bestimmen. Dieses Labor betont visuelle Messungen im Umgang mit dem Meniskus der Bürette und unterstützt zwei verschiedene Konfigurationen.
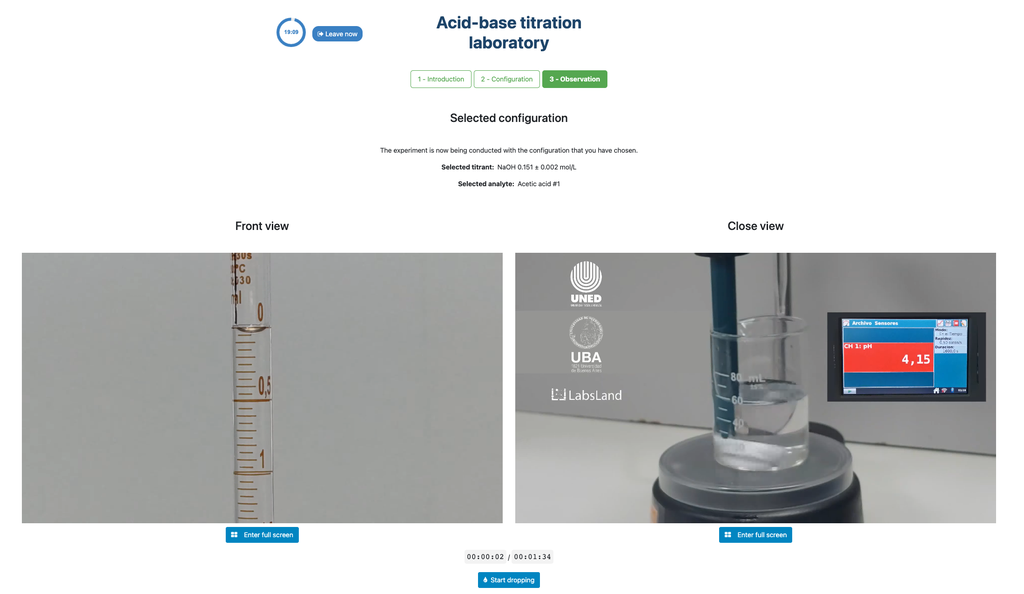
Die erste ist für einen potentiometrischen Ansatz: Sie haben Zugang zu einem digitalen pH-Sensor und können diesen verwenden, um den Neutralisationspunkt der unbekannten Lösung zu bestimmen.
Die zweite ist für einen kolorimetrischen Ansatz: Sie können sich auf die Farbänderung aufgrund des Vorhandenseins eines Phenolphthalein-Indikators verlassen, ohne dass ein digitaler pH-Sensor verfügbar ist.
Säure-Base-Titration
Titrationen sind eine volumetrische Methode, die auf der Messung der Menge eines Reaktanten bekannter Konzentration basiert (bekannt als Primärstandard), der von einer Probe unbekannter Konzentration, dem sogenannten Analyten, verbraucht wird.
Die Titration wird durchgeführt, indem der Titrant dem Analyten unter Verwendung einer Bürette zugegeben wird, um eine chemisch äquivalente Substanz zwischen dem Titranten und dem Analyten zu erhalten. Dies wird als "Äquivalenzpunkt" bezeichnet und ist ein theoretischer Wert, der experimentell nicht bestimmt werden kann.
Die experimentelle Schätzung dieses Punktes wird durch eine Annäherung bekannt als "Endpunkt" erreicht. Dies wird durch eine physikalische Änderung bestimmt. In diesem Fall wird die Farbänderung der Lösung durch Zugabe einer Indikatorsubstanz erreicht: eine Substanz, die bei bestimmten pH-Bereichen die Farben ändert.
Für die Säure-Base-Titration verwenden wir einen Phenolphthalein-Indikator, der bei einem pH-Wert von etwa 8,4 eine hellrosa Färbung annimmt, ein Wert, der dem Äquivalenzpunkt in den häufigsten Säure-Base-Titrationen sehr nahekommt.
Alternativ kann in der potentiometrischen Konfiguration ein digitaler pH-Sensor verwendet werden, um den "Äquivalenzpunkt" zu bestimmen.
Kolorimetrischer vs Potentiometrischer Ansatz
Der kolorimetrische Ansatz basiert auf der Farbänderung, die durch den Phenolphthalein-Indikator durchgeführt wird. Der potentiometrische Ansatz basiert stattdessen auf der pH-Erhöhung, gemessen durch den digitalen Sensor. In dieser Version des Labors sind zwei verschiedene Konfigurationen verfügbar, eine für jeden Ansatz. In der kolorimetrischen Konfiguration können die Schüler möglicherweise den digitalen pH-Sensor nicht sehen.
Unterschiede zum Säure-Base-Titration II Labor
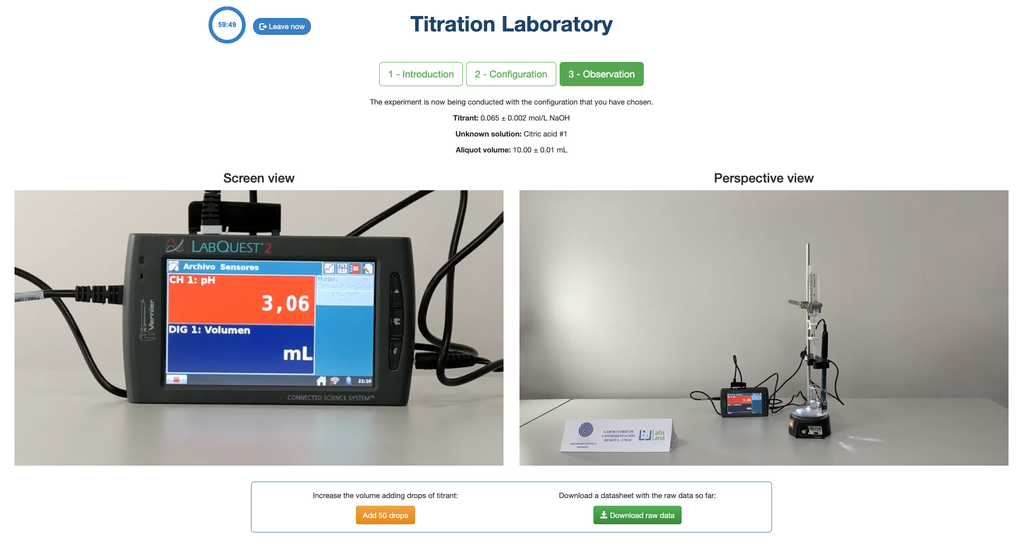
In dieser Version des Labors (Säure-Base-Titration II) können Sie die Säure-Base-Titration für eine unbekannte Essigsäurelösung durchführen. In der anderen Version des Labors (siehe Säure-Base-Titration I) können Sie stattdessen die Säure-Base-Titration für eine Zitronensäurelösung durchführen.
Diese Version des Labors betont visuelle Bürettenmessungen, einschließlich der richtigen Ablesung des Meniskus in der Bürette. Die andere Version des Labors (siehe Säure-Base-Titration I) betont dies nicht und konzentriert sich stattdessen auf die Berechnungen.
Auch in dieser Version können Sie zwischen zwei verschiedenen Konfigurationen wählen: eine für den potentiometrischen Ansatz und eine für den kolorimetrischen Ansatz. Die Konfiguration für den kolorimetrischen Ansatz zeigt den pH-Sensor nicht an. In der anderen Version des Labors (siehe Säure-Base-Titration I) gibt es eine einzige Konfiguration und der Sensor wird immer angezeigt.
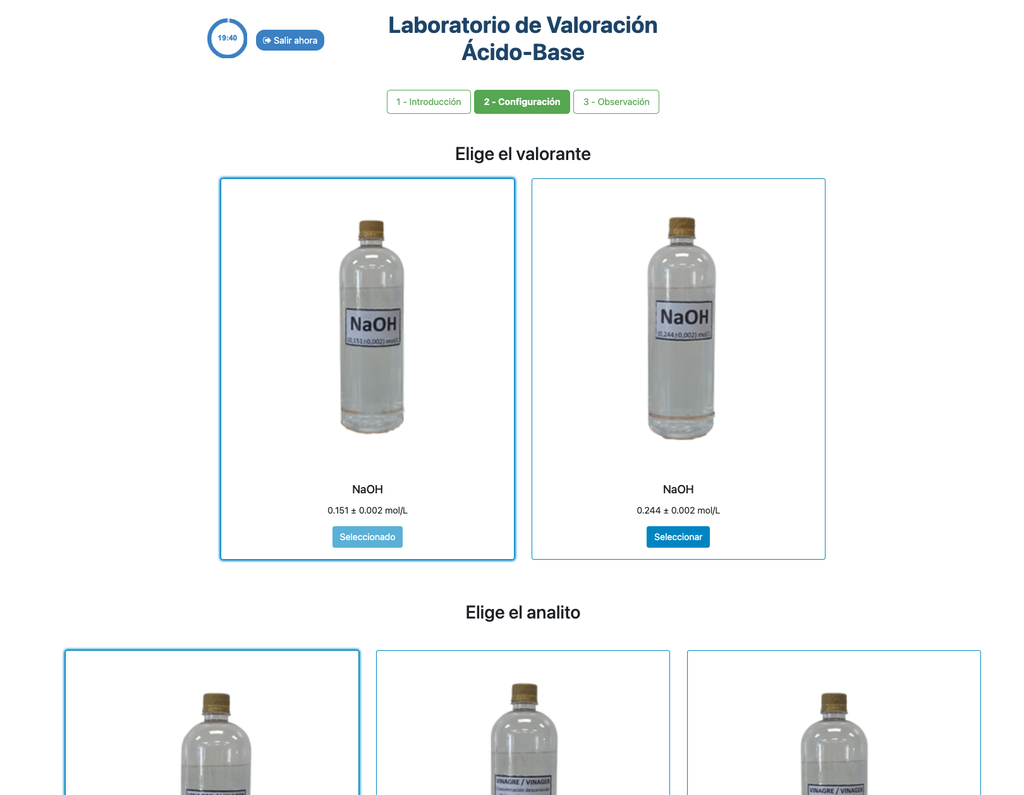
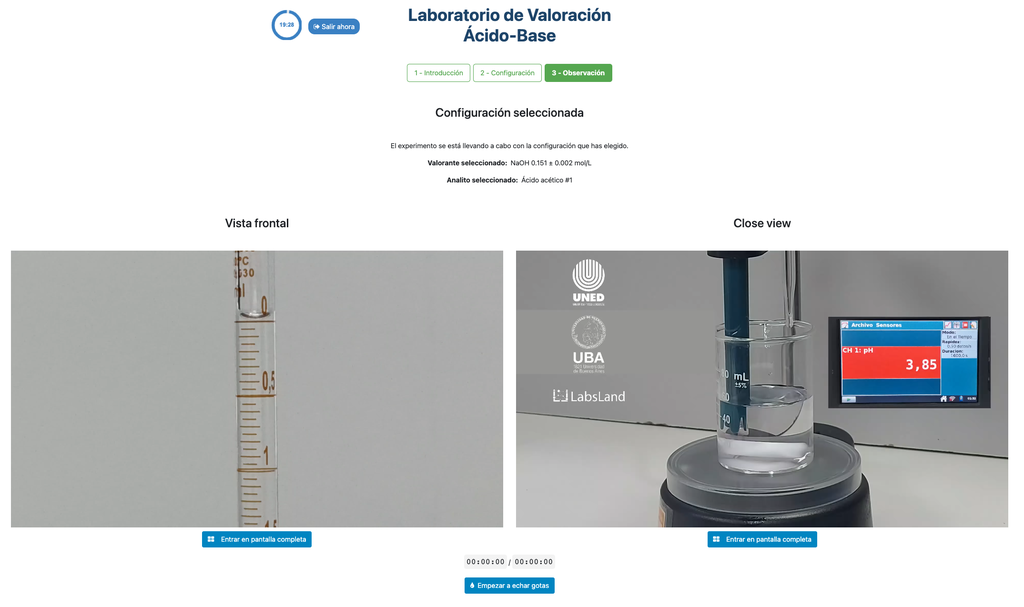
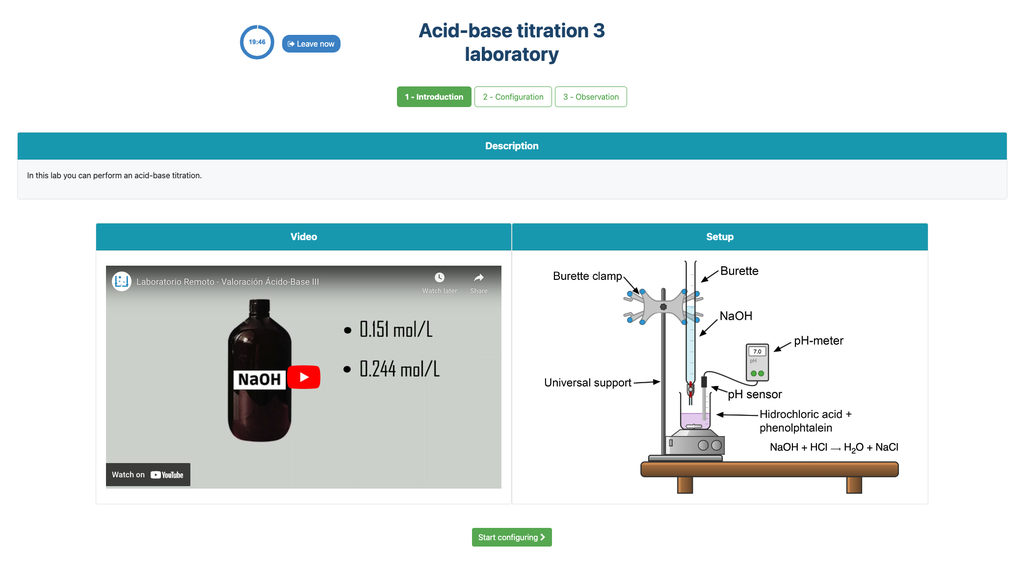
Säure-Base-Titration III
Zusammenfassung
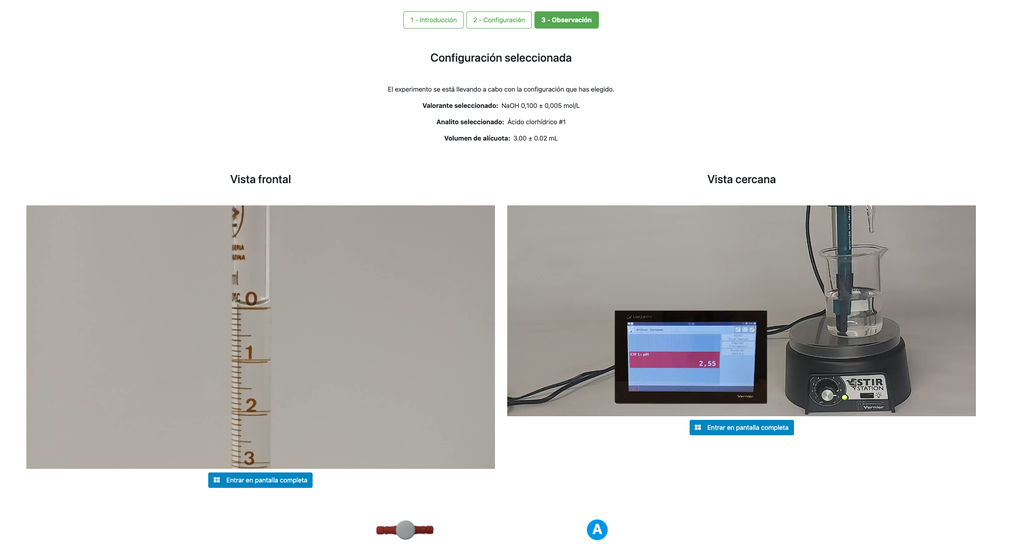
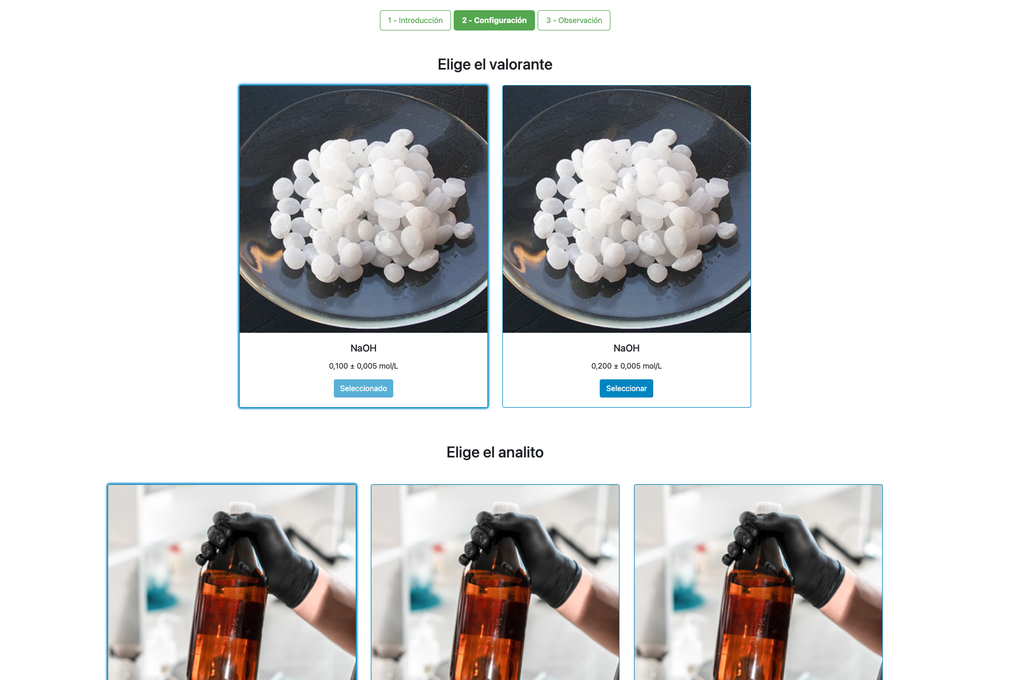
Führen Sie eine Säure-Base-Titration durch, um die Konzentration einer unbekannten Salzsäurelösung mit einem Natriumhydroxititrant zu bestimmen. Dieses Labor betont visuelle Messungen im Umgang mit dem Meniskus der Bürette und unterstützt zwei verschiedene Konfigurationen.
Die erste ist ein potentiometrischer Ansatz: Sie haben Zugriff auf einen digitalen pH-Sensor und können diesen verwenden, um zu bestimmen, wann die unbekannte Lösung neutralisiert wurde.
Die zweite ist ein kolorimetrischer Ansatz: Sie können sich auf die Farbänderung aufgrund des Vorhandenseins eines Phenolphthaleinindikators verlassen, ohne einen digitalen pH-Sensor zur Verfügung zu haben.
Säure-Base-Titration
Titrationen sind eine volumetrische Methode, die auf der Messung der Menge eines Reagens bekannter Konzentration (bekannt als Primärstandard) basiert, die von einer Probe unbekannter Konzentration, dem Analyten, verbraucht wird.
Die Titration wird durchgeführt, indem der Titrant mittels einer Bürette zum Analyten hinzugefügt wird, um eine chemisch äquivalente Substanz zwischen dem Titranten und dem Analyten zu erhalten. Dies wird als "Äquivalenzpunkt" bezeichnet und ist ein theoretischer Wert, der experimentell nicht bestimmt werden kann.
Die experimentelle Schätzung dieses Punktes wird durch eine Annäherung, die als "Endpunkt" bekannt ist, erreicht. Dies wird durch eine physikalische Veränderung bestimmt. In diesem Fall wird die Farbänderung der Lösung erzielt, nachdem eine Indikatorsubstanz hinzugefügt wurde: eine Substanz, die ihre Farbe in bestimmten pH-Bereichen ändert.
Für die Säure-Base-Titration verwenden wir einen Phenolphthaleinindikator, der nach einem pH von etwa 8,4 hellrosa wird, was einem Wert entspricht, der dem Äquivalenzpunkt in den häufigsten Säure-Base-Titrationen sehr nahe kommt.
Alternativ kann in der potentiometrischen Konfiguration ein digitaler pH-Sensor verwendet werden, um den "Äquivalenzpunkt" zu bestimmen.
Kolorimetrischer vs. potentiometrischer Ansatz
Der kolorimetrische Ansatz stützt sich auf die Farbänderung, die der Phenolphthaleinindikator bietet. Der potentiometrische Ansatz verlässt sich stattdessen auf den pH-Anstieg, wie er vom digitalen Sensor gemessen wird. In dieser Version des Labors stehen zwei verschiedene Konfigurationen zur Verfügung, eine für jeden Ansatz. In der kolorimetrischen Konfiguration können die Schüler den digitalen pH-Sensor möglicherweise nicht sehen.
Unterschiede zu den anderen Titrationslaboratorien
In dieser Version des Labors (Säure-Base-Titration II) können Sie die Säure-Base-Titration für eine unbekannte Salzsäurelösung durchführen. In anderen Versionen des Labors können Sie die Säure-Base-Titration stattdessen für eine Zitronensäurelösung (Säure-Base-Titration I) und Essigsäure (Säure-Base-Titration II) durchführen.
Sowohl diese Version des Labors (Säure-Base-Titration III) als auch Säure-Base-Titration II betonen visuelle Büretten-Messungen, einschließlich des richtigen Ablesens des Meniskus in der Bürette. Die andere Version des Labors (siehe Säure-Base-Titration I) betont dies nicht und konzentriert sich stattdessen auf die Berechnungen.
Auch in diesen Versionen können Sie zwischen zwei verschiedenen Konfigurationen wählen: einer für den potentiometrischen Ansatz und einer für den kolorimetrischen Ansatz. Die Konfiguration für den kolorimetrischen Ansatz zeigt den pH-Sensor nicht an. In einer anderen Version des Labors (siehe Säure-Base-Titration I) gibt es nur eine Konfiguration und der Sensor wird immer angezeigt.
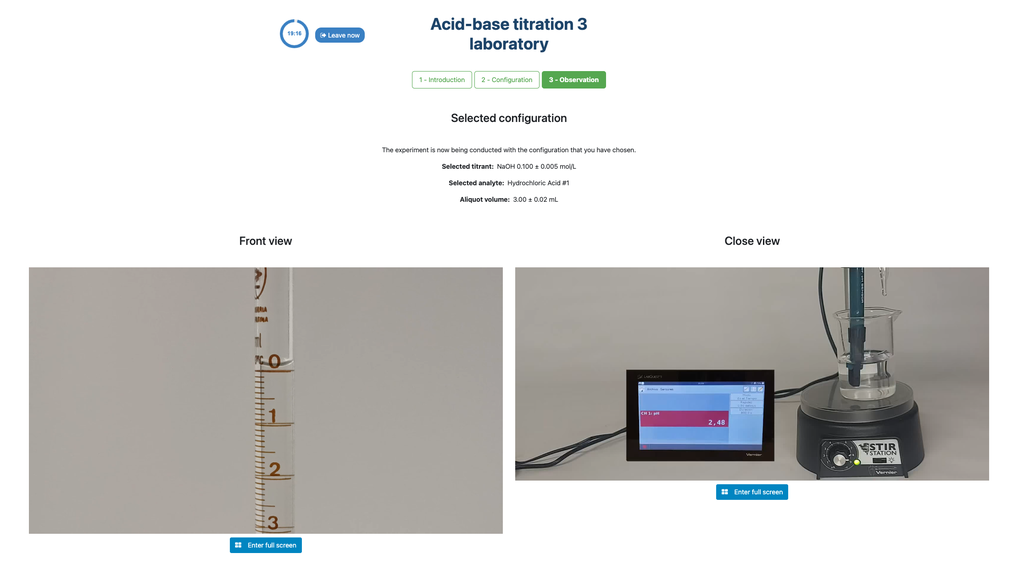
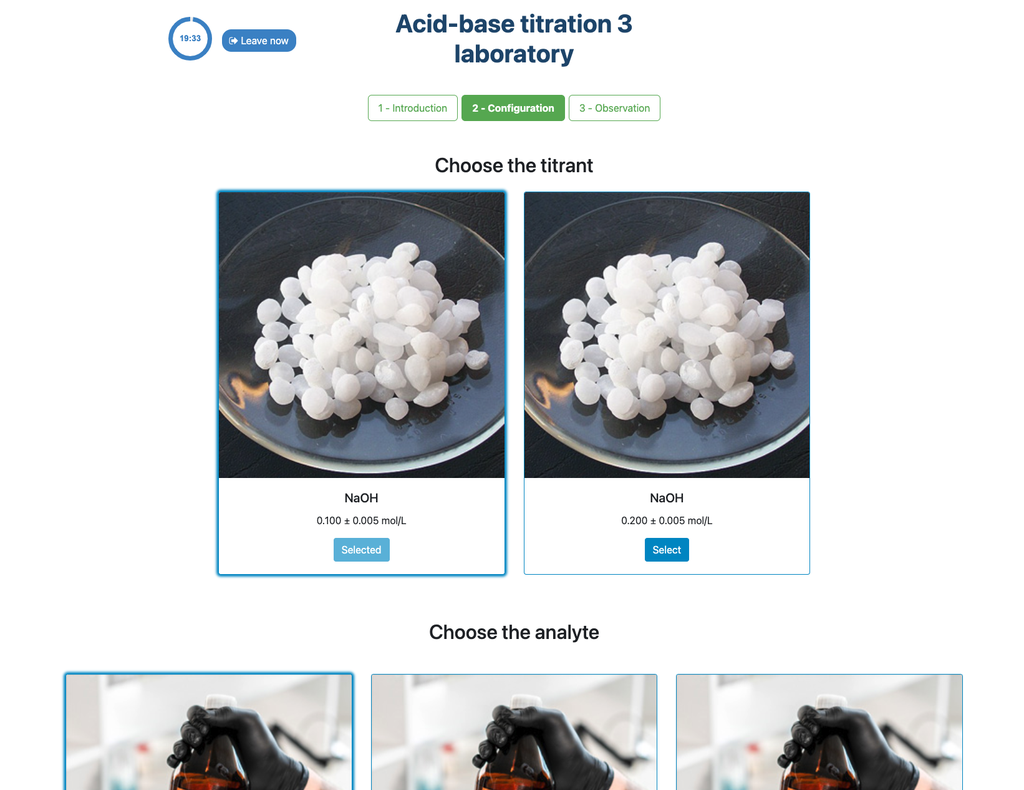

Säure-Base-Titration I
Zusammenfassung
Führen Sie eine Säure-Base-Titration durch, um die Konzentration einer unbekannten Zitronensäurelösung mit einem Natriumhydroxidtitranten zu bestimmen. Ein digitaler pH-Sensor steht immer zur Verfügung und ein Phenolphthalein-Indikator wurde in die unbekannte Lösung gegeben, sodass sowohl ein potentiometrischer als auch ein kolorimetrischer Ansatz verwendet werden können. Ein Echtzeit-Diagramm ist ebenfalls verfügbar.
Säure-Base-Titration
Titrationen sind eine volumetrische Methode, die auf der Messung der Menge eines Reagenzes bekannter Konzentration (als Primärstandard bekannt) beruht, das von einer Probe unbekannter Konzentration, dem Analyt, verbraucht wird.
Die Titration wird durchgeführt, indem der Titrant mit einer Bürette dem Analyt hinzugefügt wird, um eine chemisch äquivalente Substanz zwischen dem Titranten und dem Analyt zu erhalten. Dies wird als "Äquivalenzpunkt" bezeichnet und ist ein theoretischer Wert, der experimentell nicht bestimmt werden kann.
Die experimentelle Schätzung dieses Punktes erfolgt durch eine Näherung, die als "Endpunkt" bekannt ist. Dieser wird durch eine physikalische Veränderung bestimmt. In diesem Fall wird die Farbänderung der Lösung nach Zugabe eines Indikators erreicht: einer Substanz, die ihre Farbe in bestimmten pH-Bereichen ändert.
Für die Säure-Base-Titration verwenden wir einen Phenolphthalein-Indikator, der nach einem pH-Wert von etwa 8,4 zu einem hellen Rosa wird, was einem Wert entspricht, der dem Äquivalenzpunkt bei den häufigsten Säure-Base-Titrationen sehr nahe kommt.
Kolorimetrische vs. potentiometrische Ansätze
Der kolorimetrische Ansatz beruht auf der Farbänderung durch den Phenolphthalein-Indikator. Der potentiometrische Ansatz beruht stattdessen auf dem pH-Anstieg, wie er vom digitalen Sensor gemessen wird. In dieser Version des Säure-Base-Titrationslabors können beide Ansätze verwendet werden. Der digitale Sensor ist immer verfügbar und kann nicht verborgen werden.
Unterschiede zum Säure-Base-Titrationslabor II
In dieser Version des Labors (Säure-Base-Titration I) können Sie die Säure-Base-Titration für eine unbekannte Zitronensäurelösung durchführen. In der anderen Version des Labors (siehe Säure-Base-Titration II) können Sie die Säure-Base-Titration für eine Essigsäurelösung durchführen.
Diese Version des Labors betont die Berechnungen, hat jedoch keine visuellen Bürettenmessungen unter ihren Lernzielen. Die andere Version des Labors (siehe Säure-Base-Titration II) betont visuelle Messungen, und die Studierenden müssen lernen, den Meniskus der Bürette richtig abzulesen.
Außerdem gibt es in dieser Version eine einzige Erfahrung, die sowohl für den kolorimetrischen als auch den potentiometrischen Ansatz verwendet werden kann. In der anderen Version des Labors (siehe Säure-Base-Titration II) gibt es zwei verschiedene Konfigurationen, bei denen in einer der digitale Sensor verborgen ist, sodass die Studierenden sich nur auf die Farbänderung verlassen können.
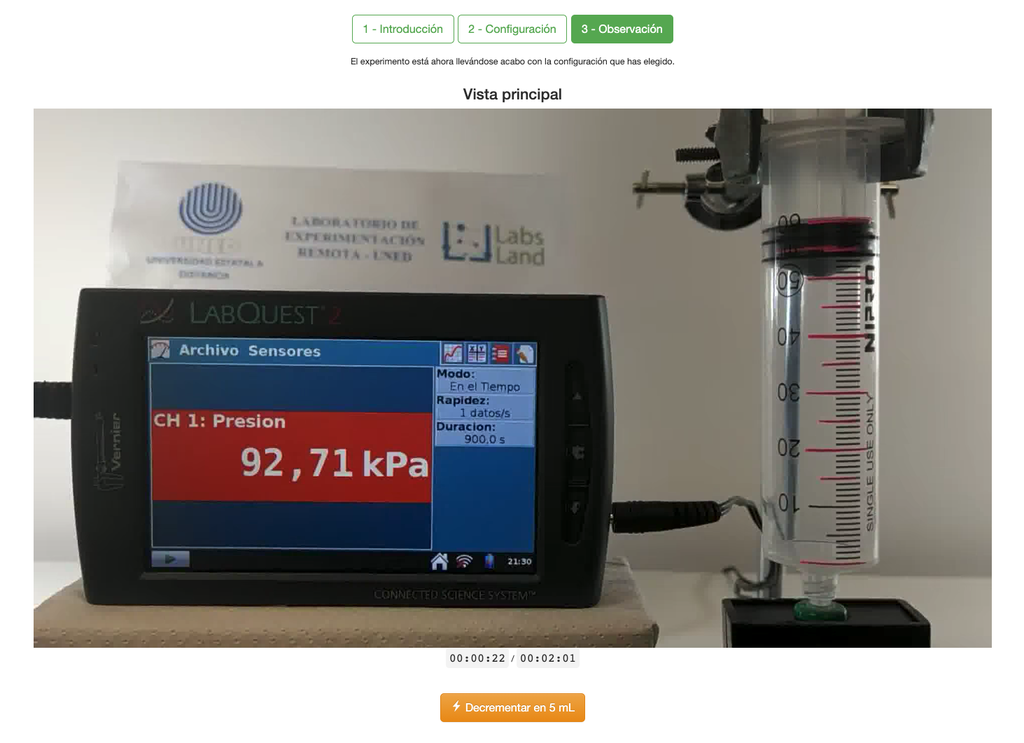
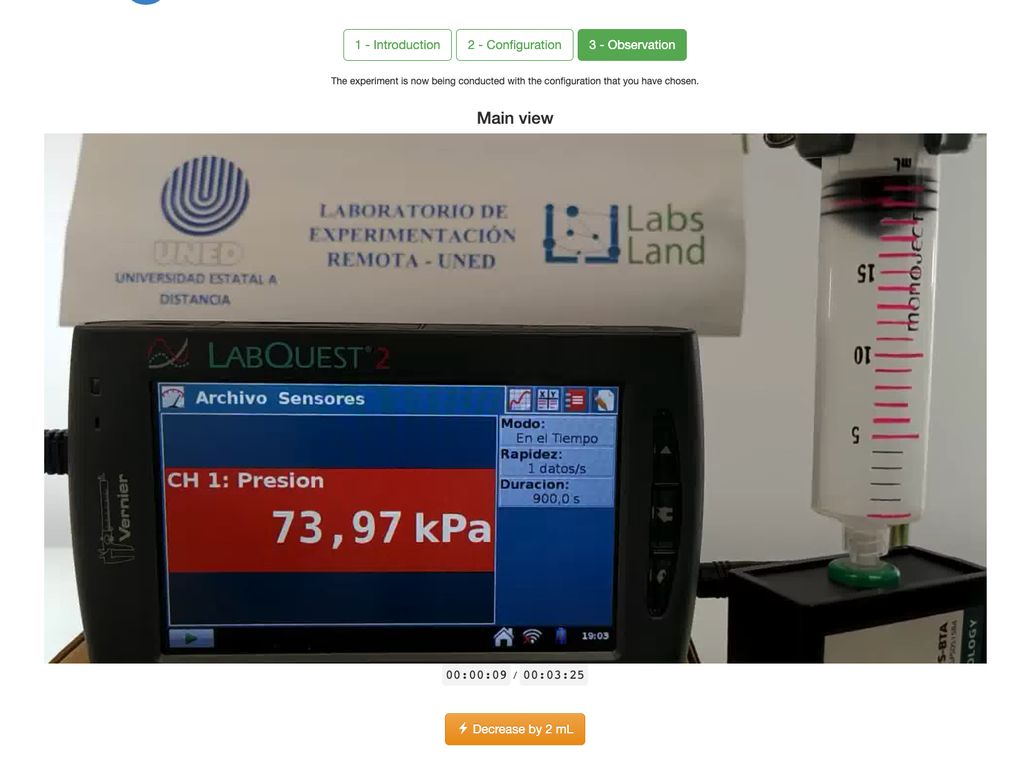
Boyle'sches Gesetz
Zusammenfassung
Das Boyle'sche Gesetz Labor ermöglicht es den Schülern, die Beziehung zwischen dem Druck und dem Volumen eines Gases bei Umgebungstemperatur und konstanter Temperatur zu bestimmen. Die Schüler können zwischen zwei verschiedenen Volumenspritzen wählen und den Druck des Gases messen, während sie das Volumen reduzieren. Das Experiment wird in einer grafischen Analyse in Form eines Isothermen dargestellt. Auf diese Weise können sie das Boyle'sche Gesetz überprüfen und das Verhalten von Gasen auf praktische und zugängliche Weise kennenlernen.
Boyle'sches Gesetz
Das Boyle'sche Gesetz besagt, dass bei konstanter Temperatur das Volumen eines Gases umgekehrt proportional zu seinem Druck ist. Das bedeutet, dass, wenn der Druck eines Gases zunimmt, sein Volumen abnimmt und umgekehrt. Das Boyle'sche Gesetz kann mathematisch ausgedrückt werden als:
V ∝ 1/P
Dabei ist V das Volumen des Gases und P der Druck des Gases.
Das Boyle'sche Gesetz Labor ermöglicht es den Schülern, dieses Gesetz in die Praxis umzusetzen und es in einem experimentellen Kontext zu überprüfen. Indem sie das Volumen und den Druck des Gases zu verschiedenen Zeiten messen, können sie ein Isothermendiagramm zeichnen, das zeigt, wie sich das Volumen des Gases in Abhängigkeit von seinem Druck ändert. Wenn das Isothermendiagramm dem Boyle'schen Gesetz entspricht, haben die Schüler das Gesetz experimentell überprüft.
Experimente wie dieses durchzuführen, ist eine ausgezeichnete Möglichkeit, das Verhalten von Gasen zu lernen und zu verstehen, wie verschiedene Variablen miteinander verbunden sind. Darüber hinaus können praktische Experimente zugänglicher und einprägsamer für die Schüler sein, als einfach nur über das Gesetz in einem Lehrbuch zu lesen. Das Isothermendiagramm visualisiert deutlich das Verhalten des Gases und überprüft, ob die Vorhersagen des Boyle'schen Gesetzes erfüllt sind.
Anwendung in der Sekundar- und Universitätserziehung
Das Boyle'sche Gesetz Labor wird typischerweise in naturwissenschaftlichen Kursen auf Gymnasialniveau und in Chemiekursen auf Universitätsniveau angewendet. Auf Gymnasialniveau kann das Labor in einem naturwissenschaftlichen Kurs angewendet werden, in dem die grundlegenden Konzepte der Chemie und Physik, wie der Druck und das Volumen von Gasen, studiert werden. An der Universität kann das Boyle'sche Gesetz Labor in einem fortgeschritteneren Chemiekurs angewendet werden, in dem das Studium der Gase und ihres Verhaltens vertieft wird.
Ziele
Ein Boyle'sches Gesetz Labor kann unterschiedliche Bildungsziele haben, je nach dem Bildungsniveau, auf dem es angewendet wird. Hier sind einige Beispiele für Ziele, die ein Boyle'sches Gesetz Labor auf Gymnasial- und Universitätsniveau haben kann:
Auf Gymnasialniveau:
- Die Schüler verstehen das Boyle'sche Gesetz und seine Bedeutung in der Gasphysik.
- Die Schüler üben experimentelle und Beobachtungsfähigkeiten.
- Die Schüler entwickeln Fähigkeiten zur Datenanalyse und -darstellung.
- Die Schüler verstehen die Beziehung zwischen Temperatur, Druck und Volumen von Gasen.
Auf Universitätsniveau:
- Die Schüler kennen das Boyle'sche Gesetz und seine Bedeutung in der Gasphysik.
- Die Schüler demonstrieren experimentelle und Beobachtungsfähigkeiten im Labor.
- Die Schüler wenden theoretische Konzepte der Gasphysik in praktischen Situationen an.
- Die Schüler entwickeln Fähigkeiten zur Datenanalyse und -darstellung im wissenschaftlichen Kontext.
- Die Schüler verstehen, wie Temperatur, Druck und Volumen von Gasen in unterschiedlichen Situationen zusammenhängen.
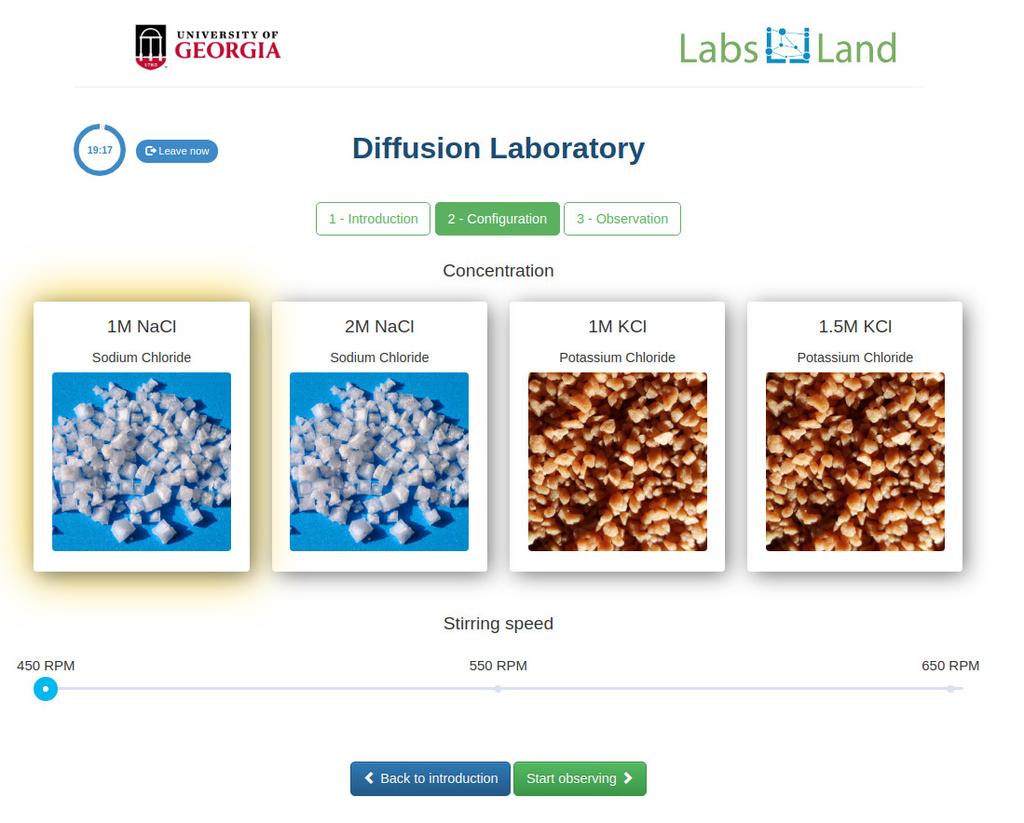
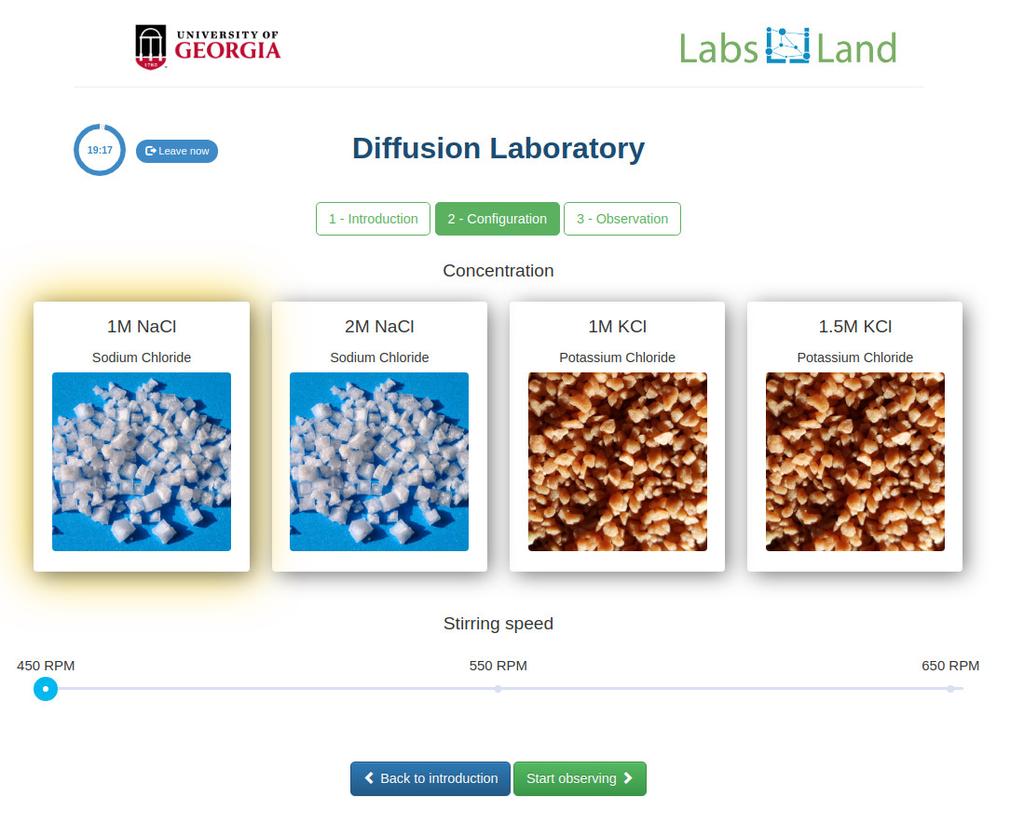
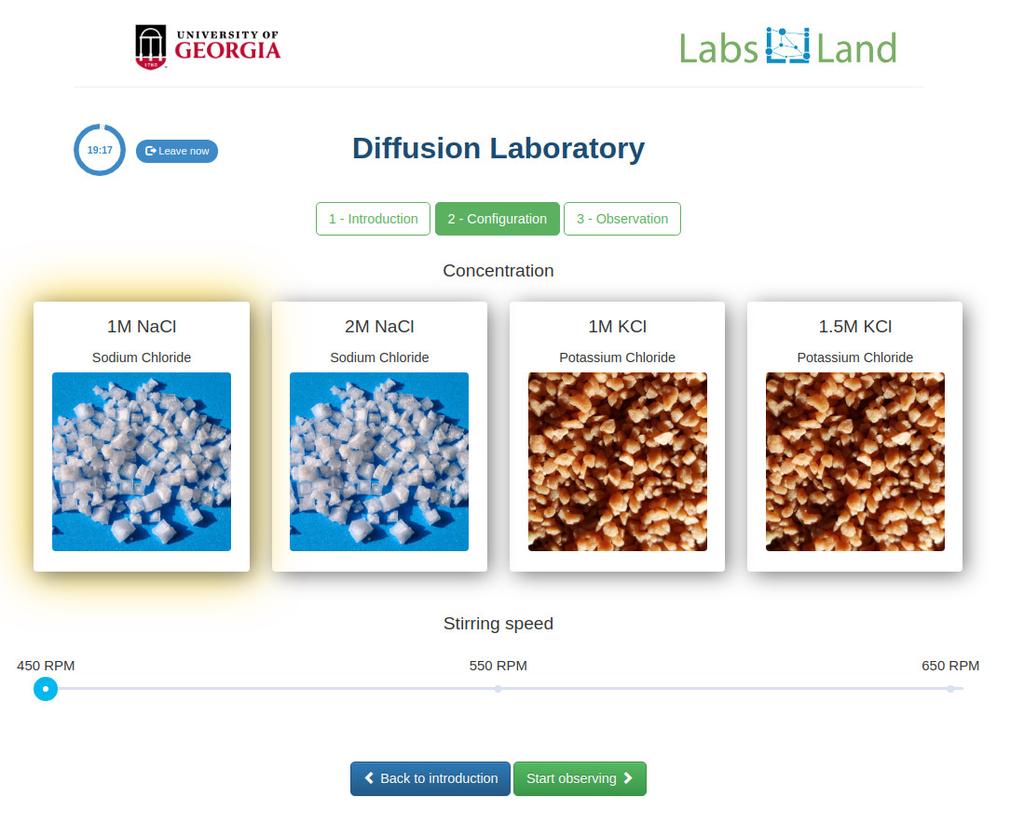
Diffusion laboratory - basic
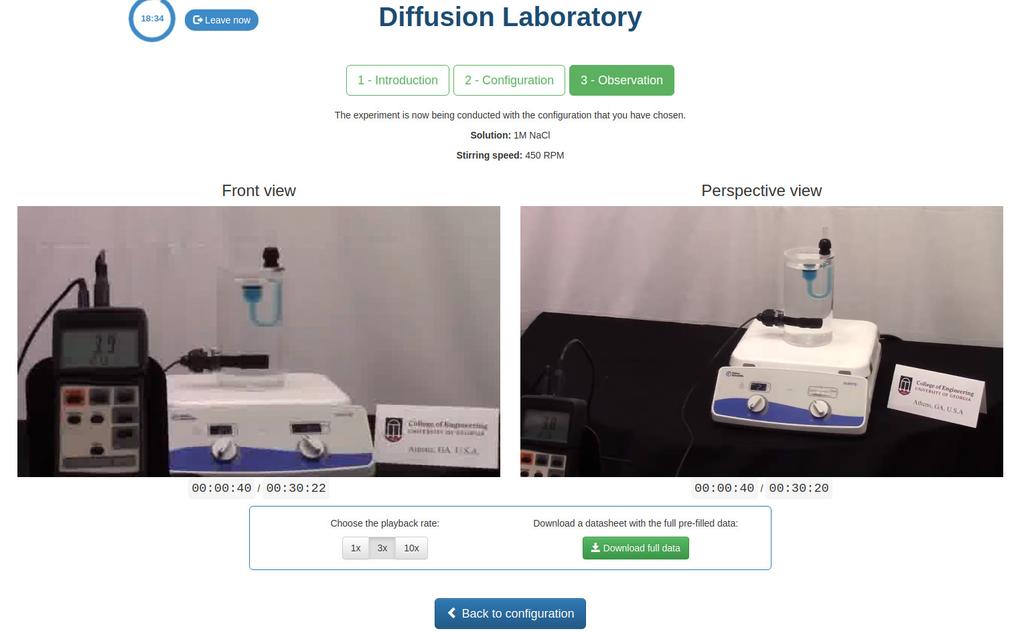
Diffusion laboratory - data
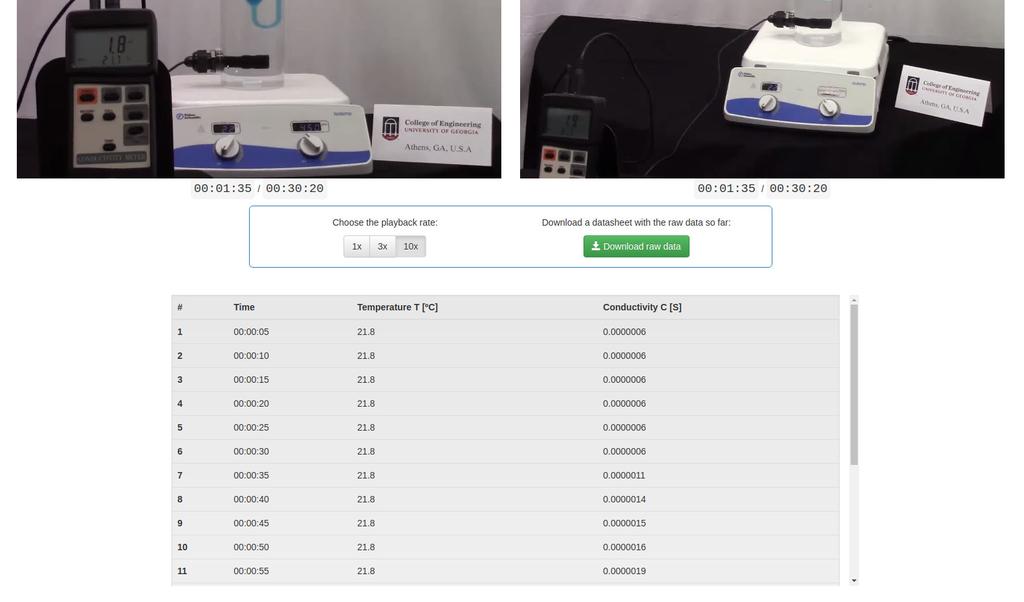
Diffusion laboratory - full
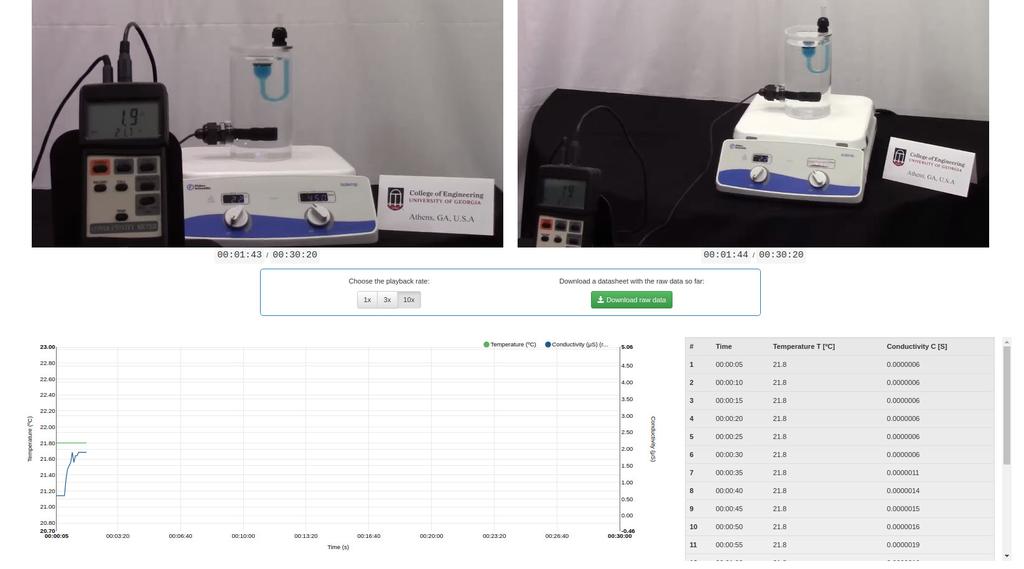
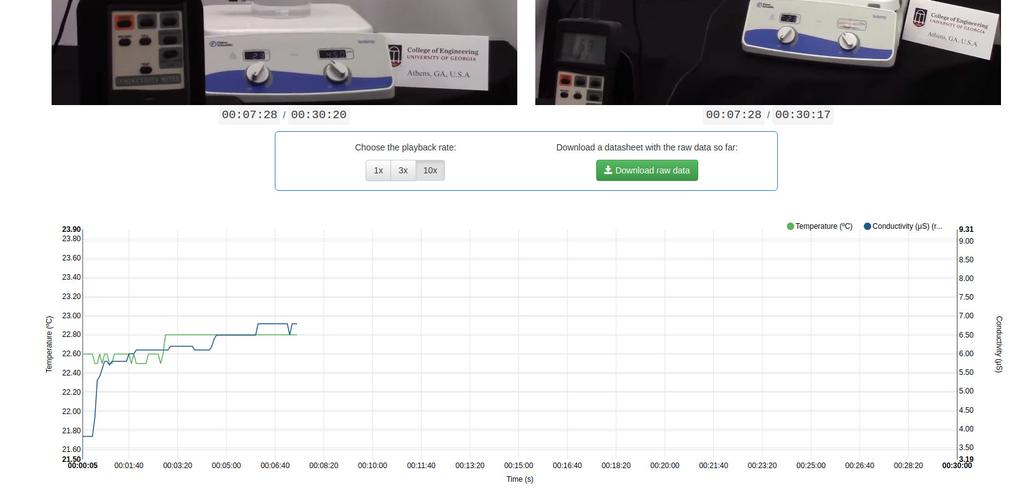
Diffusion laboratory - plot
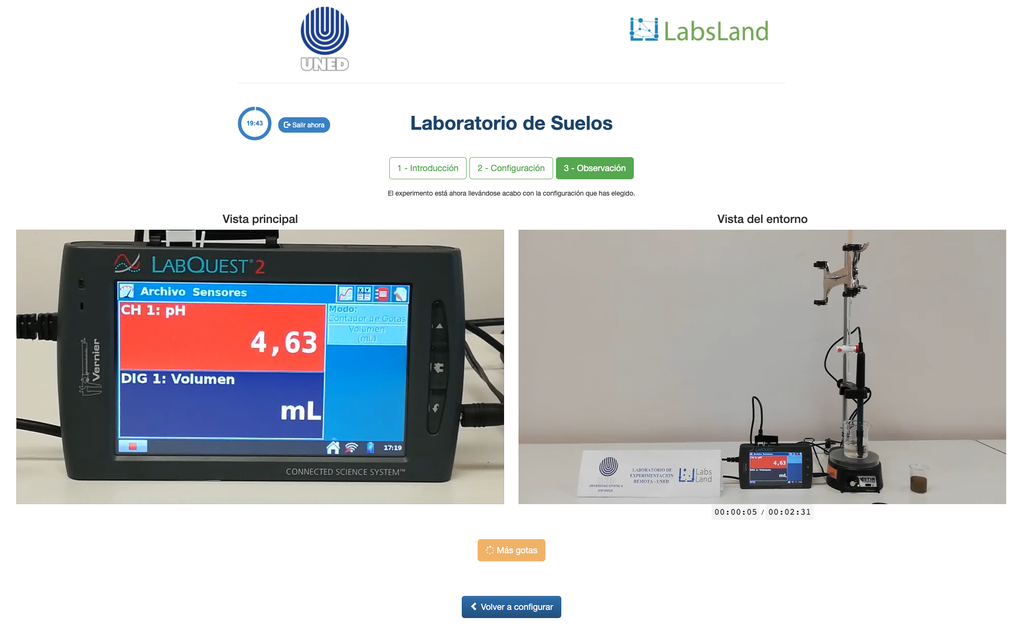
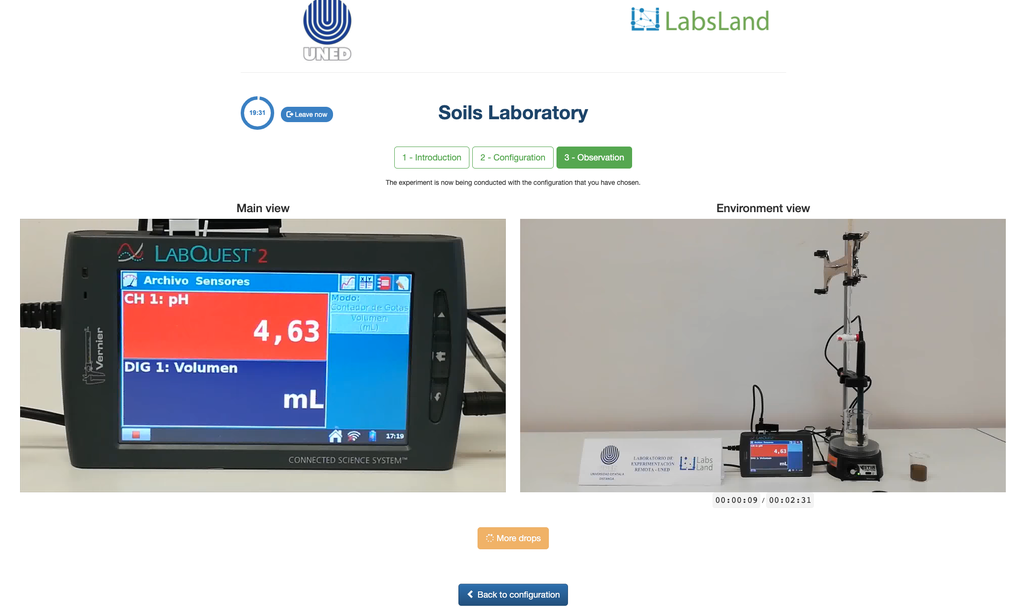
Austauschbare Acidität von Böden
Die Säuregehalt der Böden kann durch verschiedene Prozesse auftreten, die eine pH-Absenkung fördern. Diese Prozesse treten natürlich oder durch menschliches Handeln auf. Die Hauptquellen der Bodensäure sind mit Wasserstoffionen (H+) und Aluminiumionen (Al+3) in der Bodenlösung verbunden. Austauschbare Säure wird durch die Verwendung von neutralen Salzlösungen wie Kaliumchlorid (KCl) bestimmt. Die Säureionen (Aluminium und Hydronium), die in der kolloidalen Fraktion des Bodens gehalten werden, treten in Gegenwart eines verdrängenden Ions (K+) in die Bodenlösung ein. Anschließend wird diese Lösung mit einer Natriumhydroxidlösung der genauen Konzentration titriert, um den letzten Punkt der Neutralisationsreaktion mit Phenolphthalein als Indikator zu erreichen.

Gay-Lussac's Gesetz
Das Gesetz von Gay-Lussac ermöglicht es uns, das Verhalten von Gasen zu untersuchen und wird häufig in der Physik und Chemie untersucht. Es stellt einen Zusammenhang zwischen dem Druck eines Gases und seiner Temperatur her, während andere Parameter wie Volumen und Menge konstant bleiben.
Es gibt verschiedene Möglichkeiten, das Gesetz von Gay-Lussac zu überprüfen. In diesem Experiment werden wir bestätigen, dass für eine gegebene Menge Gas der Druck direkt proportional zur Temperatur ist.
Radioaktivität
Zusammenfassung
Das Setup, nützlich für Schulen und Universitäten, umfasst einen Geigerzähler, der die Anzahl der detektierten Teilchenkollisionen messen kann. Der Benutzer kann zwischen verschiedenen radioaktiven Quellen sowie einem Absorber wählen, der zwischen die radioaktive Quelle und die Sonde gestellt wird. Zusätzlich können die Benutzer andere Parameter wie den Abstand und die Anzahl der Tests variieren. Dies ermöglicht eine Vielzahl von Experimenten und Lernmöglichkeiten.
Radioaktivität
Radioaktivität ist der Prozess, bei dem ein Atomkern durch das Aussenden von Teilchen und Strahlung Energie verliert. Dies kann in bestimmten Elementen natürlich auftreten oder künstlich durch den Einsatz von Kernreaktionen herbeigeführt werden. Im Kontext der Physik an Schulen und Universitäten kann das Studium der Radioaktivität wertvolle Einblicke in die grundlegende Natur der Materie und die Gesetze der Physik bieten.
Ein häufiges Experiment in diesem Bereich ist die Messung der Radioaktivität mit einem Geigerzähler. Dieses Gerät kann die Emission von Teilchen aus einer radioaktiven Quelle detektieren und ermöglicht es den Schülern, die grundlegenden Prinzipien der Strahlung und ihre Auswirkungen auf die Materie zu verstehen. Durch das Variieren der Art der radioaktiven Quelle, des Abstands zwischen Quelle und Detektor sowie des Absorbermaterials, das dazwischengelegt wird, können Schüler eine Vielzahl von Phänomenen erkunden und ein tieferes Verständnis für die zugrunde liegenden Prinzipien gewinnen.
Zusätzlich zu seinem pädagogischen Wert hat das Studium der Radioaktivität auch praktische Anwendungen in Bereichen wie Medizin, Energieerzeugung und Umweltschutz. Daher ist es ein wichtiges Thema, über das Schüler lernen sollten, sowohl wegen des inneren Interesses als auch der vielen realweltlichen Anwendungen.
Realweltliche Anwendungen der Radioaktivität
Eine der häufigsten Anwendungen der Radioaktivität ist im Bereich der Medizin. Radioaktive Isotope werden in medizinischen Bildgebungsverfahren wie PET- und SPECT-Scans verwendet, die es Ärzten ermöglichen, in den Körper zu schauen und Krankheiten zu diagnostizieren. Radioaktive Isotope werden auch in Krebstherapien wie der Strahlentherapie verwendet, bei der sie zur Abtötung von Krebszellen eingesetzt werden.
Radioaktivität wird auch in Industrien wie der Öl- und Gasexploration verwendet, wo sie zur Messung der Durchlässigkeit von Gesteinsformationen und des Flüssigkeitsflusses durch diese verwendet wird. Radioaktive Isotope werden auch in Rauchmeldern und in der Herstellung von leuchtenden Uhren und Instrumenten verwendet.
Insgesamt hat die Radioaktivität eine breite Palette von Anwendungen in Bereichen wie Medizin, Industrie und sogar in alltäglichen Konsumgütern. Sie bleibt ein wichtiges Studiengebiet in der Physik und anderen Wissenschaften, und ihre Anwendungen erweitern sich weiter, da neue Technologien entwickelt werden.
Radioaktivitätsexperimente an Schulen und Universitäten
Der Einsatz eines Geigerzählers in einem Radioaktivitätsexperiment ermöglicht eine Vielzahl von Möglichkeiten. Durch das Variieren der Strahlungsquellen und Absorber können Schüler die Auswirkungen verschiedener Quellen und Materialien auf die detektierten Teilchenkollisionen beobachten. Dies kann den Schülern helfen, die Eigenschaften der Radioaktivität und das Verhalten verschiedener Teilchen zu verstehen.
Darüber hinaus können Experimente zur Bestimmung der Art der ausgestrahlten Teilchen durchgeführt werden, indem beobachtet wird, ob das Teilchen absorbiert wird oder nicht. Durch das Platzieren verschiedener Absorber zwischen der Quelle und der Sonde können Schüler die Eigenschaften der emittierten Teilchen bestimmen und ein tieferes Verständnis der Radioaktivität erlangen.
Schließlich können auch Experimente zur Bestimmung der geometrischen Form der Strahlungsemission mit einem Geigerzähler durchgeführt werden. Durch sorgfältige Messung der detektierten Teilchenkollisionen in verschiedenen Entfernungen können Schüler Einblicke in die räumliche Verteilung der Radioaktivität gewinnen. Dies kann den Schülern helfen, die grundlegenden Prinzipien der Radioaktivität und ihre Anwendungen in der realen Welt zu verstehen.
Mögliche Lernziele
Mögliche Ziele der im Labor durchgeführten Aktivitäten sind die folgenden:
- Verstehen der Eigenschaften und des Verhaltens radioaktiver Emissionen.
- Durchführung von Experimenten zur Messung der Auswirkungen von Strahlung auf verschiedene Materialien.
- Bestimmung der Art der von einer radioaktiven Quelle emittierten Strahlung.
- Verstehen der Prinzipien der Strahlensicherheit und des Umgangs mit Strahlung.
- Erforschung der Anwendungen der Radioaktivität in Bereichen wie Medizin, Industrie und Forschung.
- Verstehen der Prinzipien von Geigerzählern und ihrer Verwendung bei der Messung von Radioaktivität.
- Verstehen der historischen Entwicklung des Konzepts der Radioaktivität und ihrer Entdeckung.
- Erkundung der ethischen Implikationen der Verwendung radioaktiver Materialien.

Spektroskopie
Dieses ultrakonkurrierende Labor basiert auf einer experimentellen Praxis zur Röntgenspektroskopie unter Verwendung eines Geräts der Marke LEYBOLD, das in einem radiologischen Instrumentierungslabor an der Nationalen Universität von Costa Rica (Universidad Nacional de Costa Rica) installiert ist, das sich im Gebäude für Angewandte Medizinphysik befindet.
Der Aufbau besteht aus einer Röntgenröhre mit einer Anode aus Gold (Au) zusammen mit einem Szintillationsdetektor, der mit einem Vorverstärker und einem Digitalisierer konfiguriert ist, der die Verarbeitung der vom Detektor durchgeführten Messungen über Software ermöglicht.
Die Prüfung zielt darauf ab, den Strahl der Strahlungsquelle durch die experimentelle Berechnung des Spektrums des in der Röhre erzeugten Röntgenstrahls zu charakterisieren und zudem grundlegende Vorstellungen über die radiologische Instrumentierung und die Verwendung der Variation ihrer Parameter in industriellen und medizinischen Anwendungen zu vermitteln.











