Obtenez maintenant l'accès à LCAL2003: Chemistry labs (ultraconcurrent)
Pour seulement :
9,99 $USUn paiement
6 mois d'accès
Moyens de paiement pris en charge :
- DigiKey (Non disponible dans tous les pays)
- Carte de crédit ou de débit
- PayPal
Vous devez créer ou utiliser un compte LabsLand pour continuer.
Accès à distance à 12 laboratoires inclus:
Essayer d'acheter plusieurs licences pour une classe ? Contactez-nous pour des réductions de groupe
Qu'est-ce que LabsLand?
LabsLand est le réseau mondial de laboratoires à distance.
L'équipement est toujours réel, pas une simulation.
Vous contrôlez l'équipement réel avec des webcams via Internet.
Accédez maintenant. Pas besoin d'attendre qu'un équipement soit expédié.
Pas de coûts cachés : tout est inclus. Aucun accessoire ou frais d'expédition.
Très facile à utiliser : l'équipement fonctionne déjà.
Louez-le uniquement les mois dont vous avez besoin pour votre apprentissage.
Comment fonctionne LabsLand ?
LabsLand est un réseau mondial de laboratoires réels disponibles en ligne. Les étudiants (dans les écoles, les universités et les plateformes d'apprentissage tout au long de la vie) peuvent accéder aux laboratoires réels via Internet, en utilisant leur ordinateur portable, tablette ou téléphone.
Les laboratoires sont soit en temps réel (Arduino, FPGA...) situés dans différentes universités du monde entier. Dans certains domaines (Physique, Biologie, Chimie), les laboratoires sont des Laboratoires Ultraconcurrents LabsLand, donc l'université a enregistré toutes les combinaisons potentielles de ce qui peut être fait dans le laboratoire (dans certains cas, plusieurs milliers) et les rend disponibles de manière interactive.
Dans tous les cas, le laboratoire est toujours réel (non simulé) et disponible via le Web (vous n'avez pas besoin d'obtenir de matériel, de gérer l'expédition, etc.).
Découvrez comment fonctionne une session utilisateur typique dans la vidéo suivante :
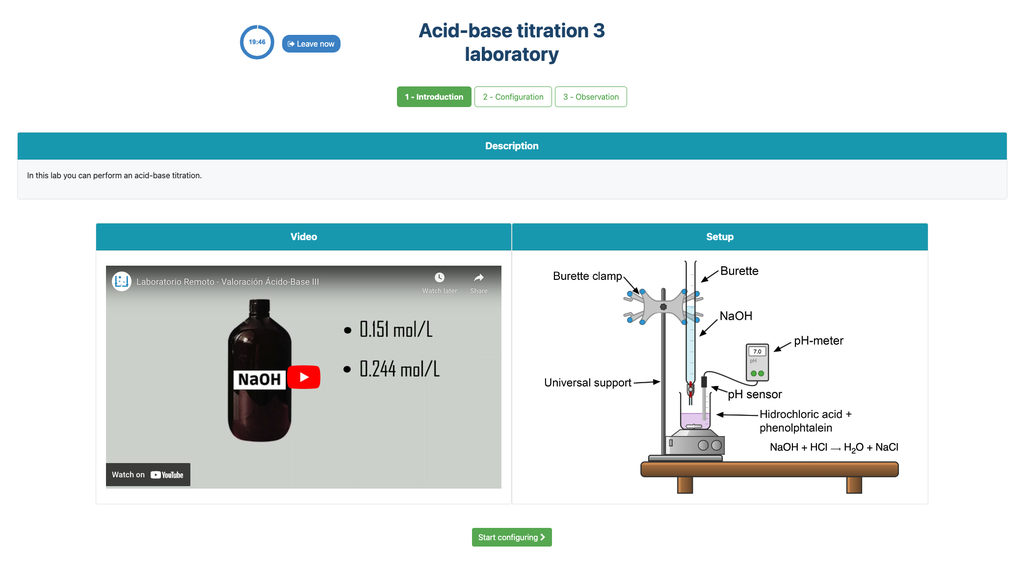
Titration Acido-basique II
Résumé
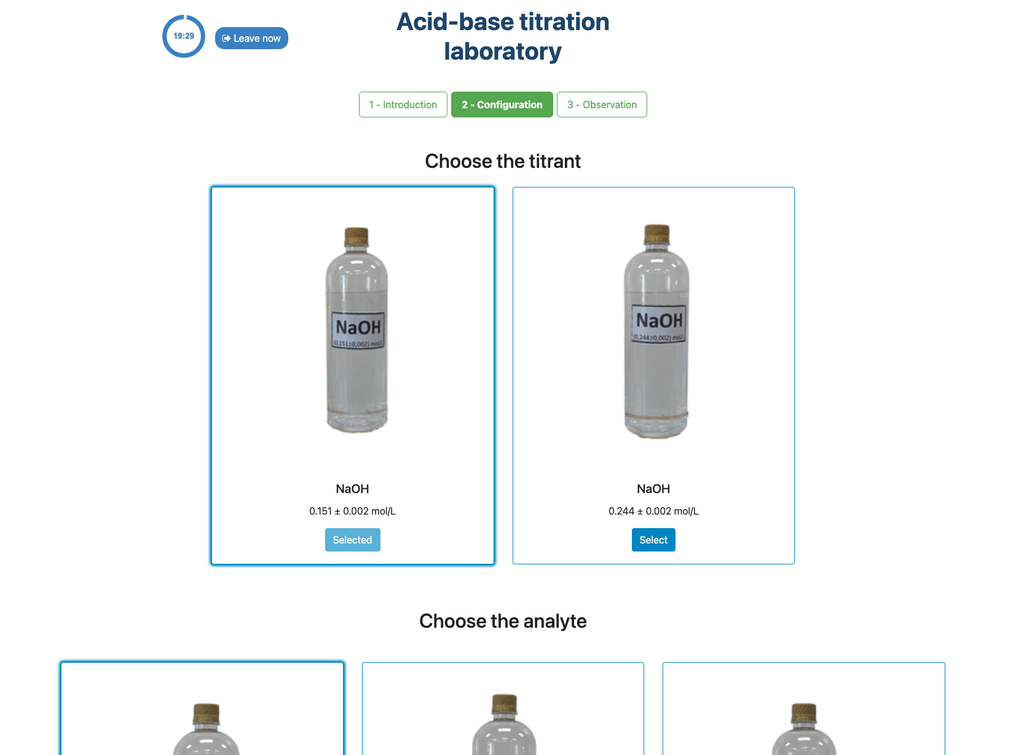
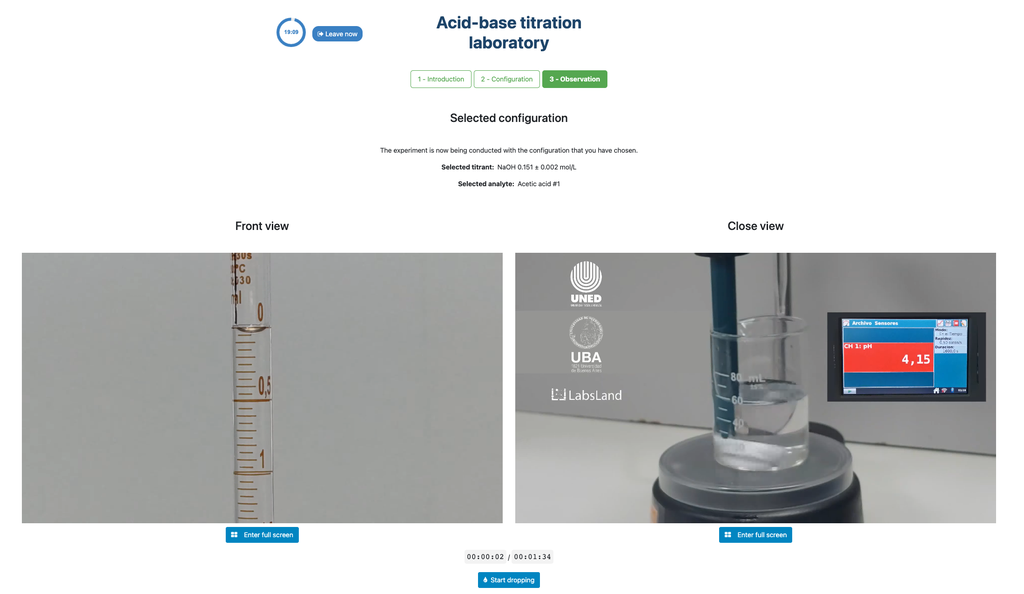
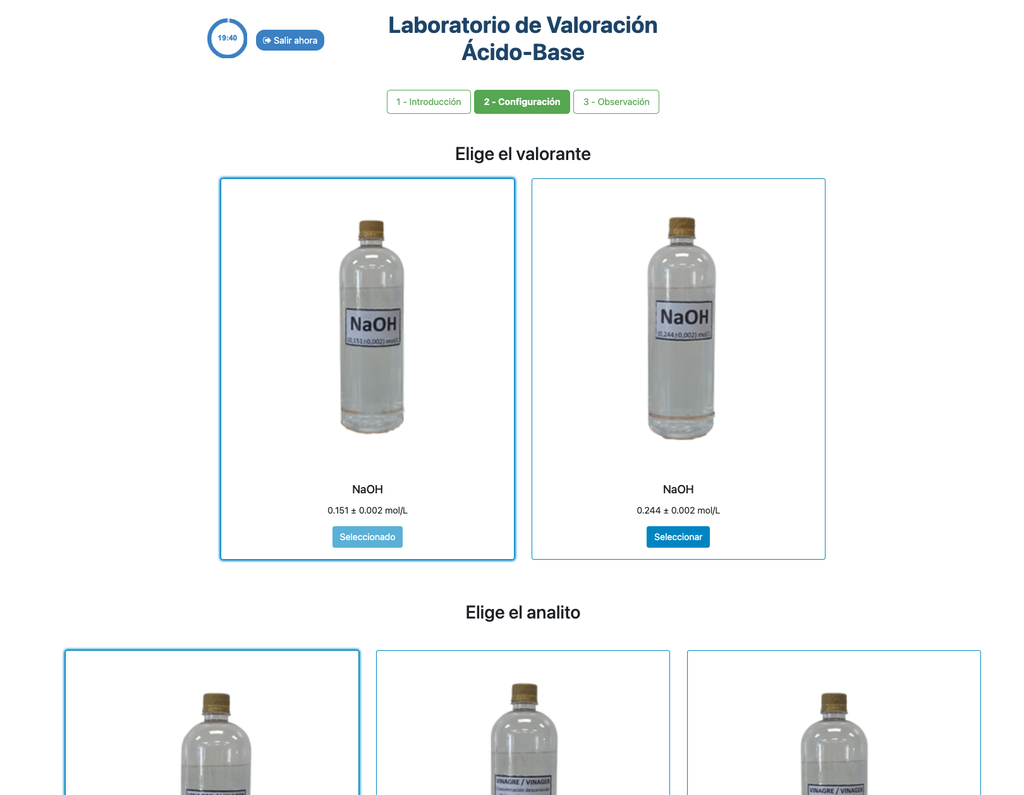
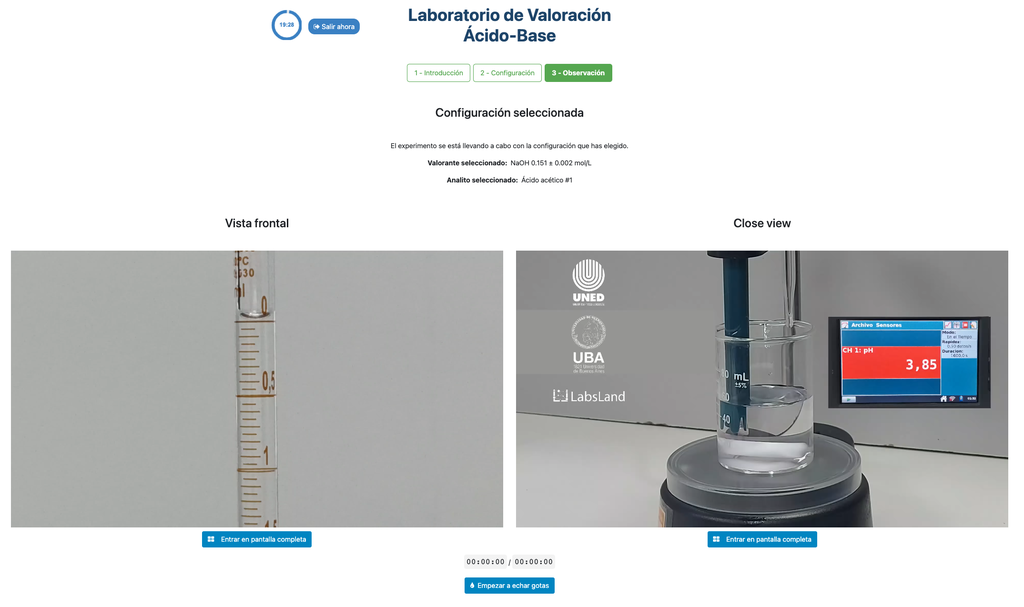
Réalisez une titration acide-base pour déterminer la concentration d'une solution d'acide acétique inconnue en utilisant un titrant d'hydroxyde de sodium. Ce laboratoire met l'accent sur les mesures visuelles concernant le ménisque de la burette, et supporte deux configurations différentes.
La première est pour une approche potentiométrique: vous aurez accès à un capteur de pH numérique et vous pourrez l'utiliser pour déterminer quand la solution inconnue a été neutralisée.
La seconde est pour une approche colorimétrique: vous pouvez vous fier au changement de couleur dû à la présence d'un indicateur de phénolphtaléine, sans avoir à votre disposition un capteur de pH numérique.
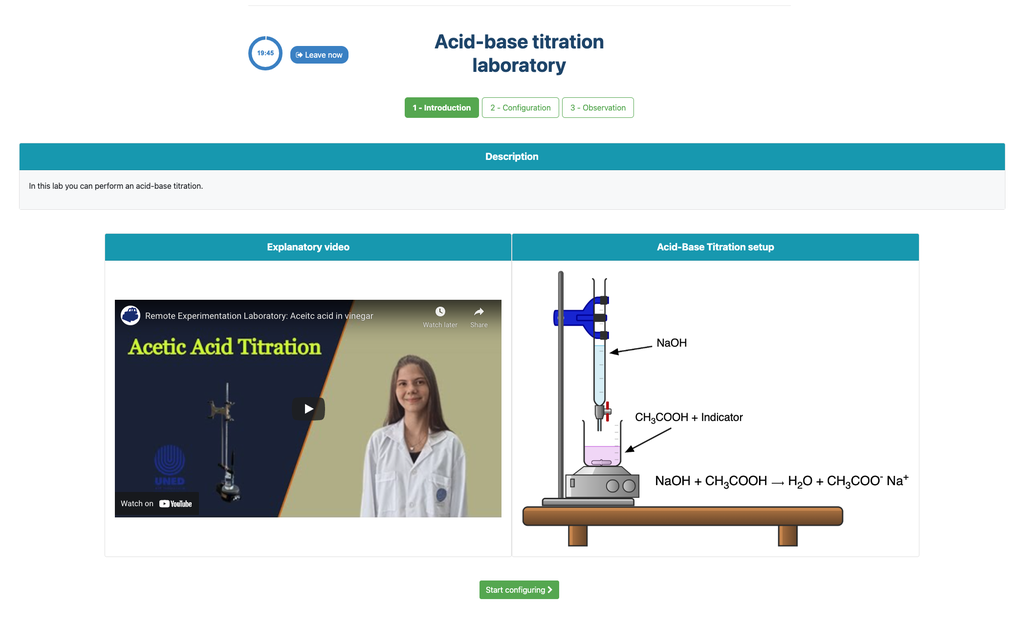
Titration acide-base
Les titrations sont une méthode volumétrique basée sur la mesure de la quantité d'un réactif de concentration connue (appelé étalon primaire) consommée par un échantillon de concentration inconnue appelé analyte.
La titration est réalisée en ajoutant le titrant à l'analyte à l'aide d'une burette, afin d'obtenir une substance chimiquement équivalente entre le titrant et l'analyte. Ce point est connu sous le nom de
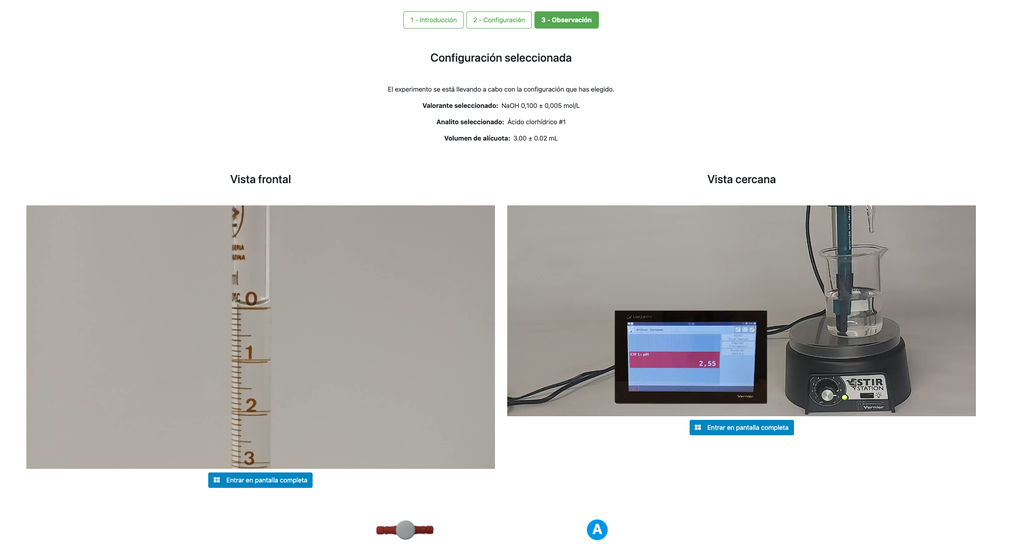
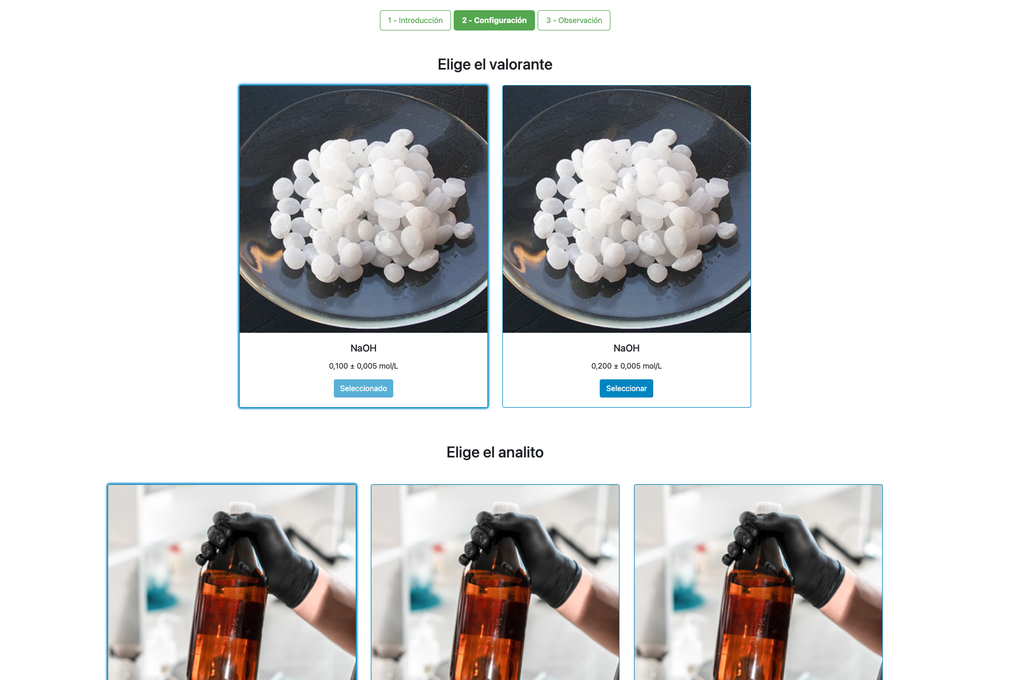
Titration acide-base III
Résumé
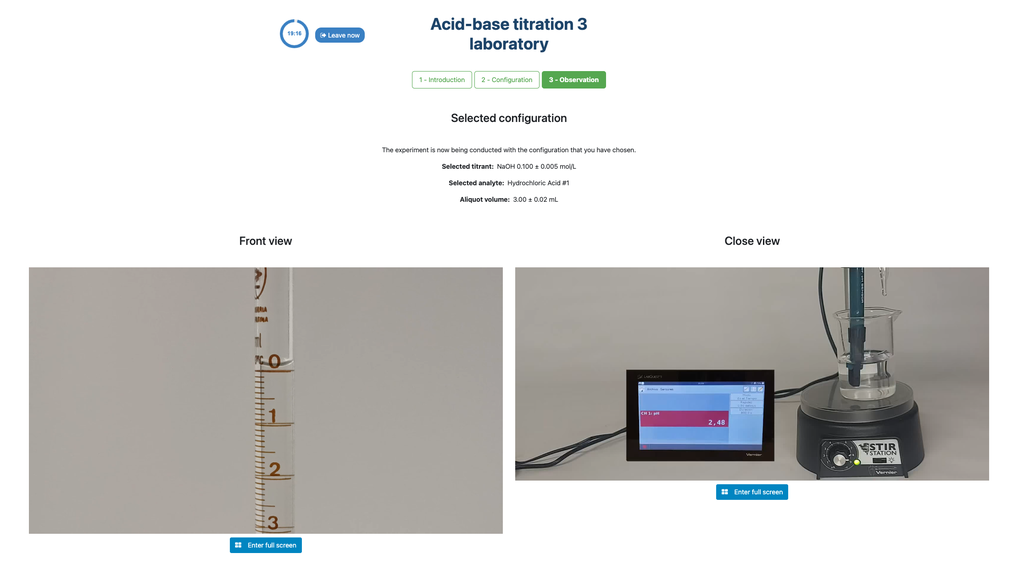
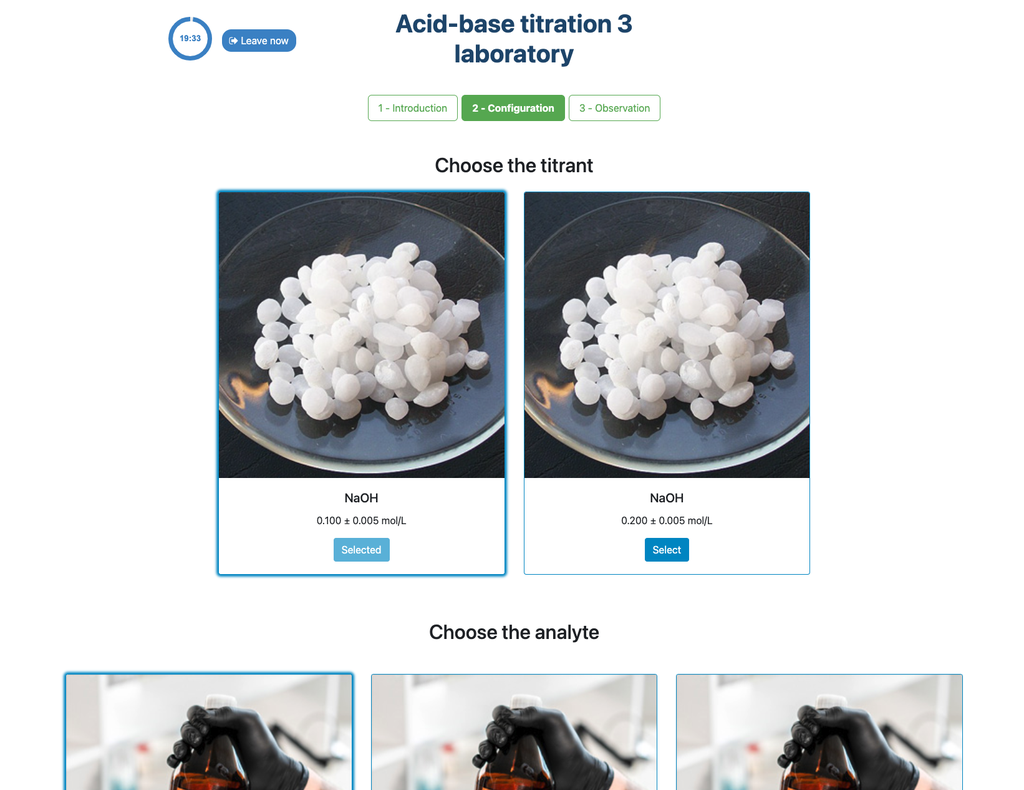
Effectuez une titration acido-basique pour déterminer la concentration d'une solution d'acide chlorhydrique inconnue en utilisant un titrant d'hydroxyde de sodium. Ce laboratoire met l'accent sur les mesures visuelles liées au ménisque de la burette et prend en charge deux configurations différentes. bsp;
La première est une approche potentiométrique : vous aurez accès à un capteur de pH numérique et vous pourrez l'utiliser pour déterminer quand la solution inconnue a été neutralisée. bsp;
La seconde est une approche colorimétrique : vous pourrez vous fier au changement de couleur dû à la présence d'un indicateur de phénolphtaléine, sans disposer d'un capteur de pH numérique.
bsp;
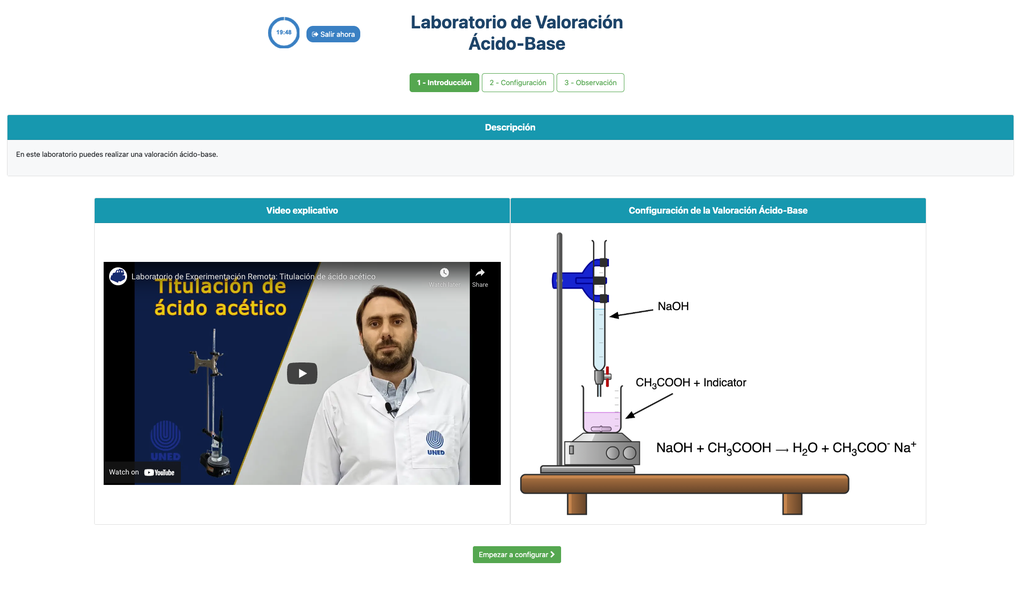
Titration acido-basique
Les titrations sont une méthode volumétrique basée sur la mesure de la quantité d'un réactif de concentration connue (appelé standard primaire) consommée par un échantillon de concentration inconnue appelée analyte.
La titration est réalisée en ajoutant le titrant à l'analyte à l'aide d'une burette, afin d'obtenir une substance chimiquement équivalente entre le titrant et l'analyte. C'est ce qu'on appelle le

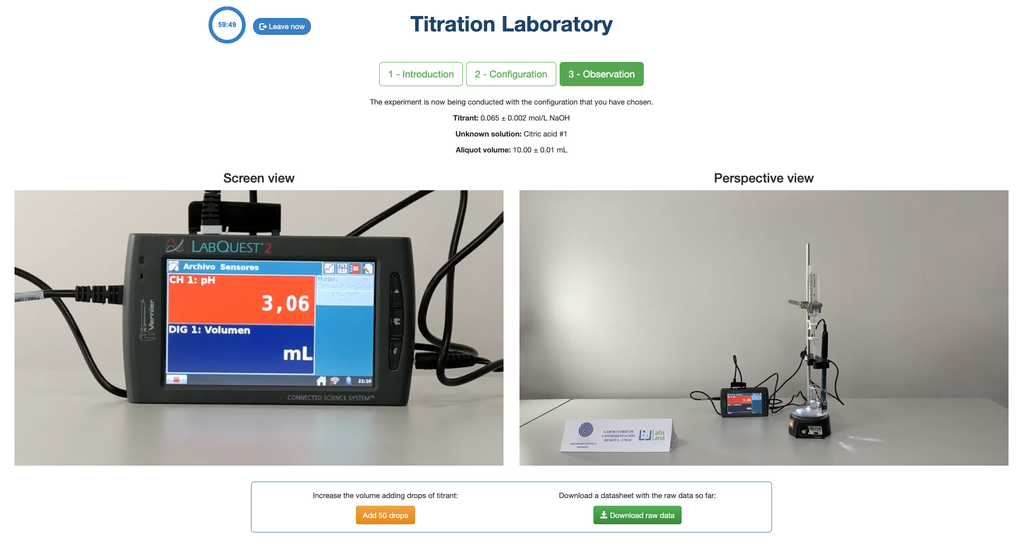
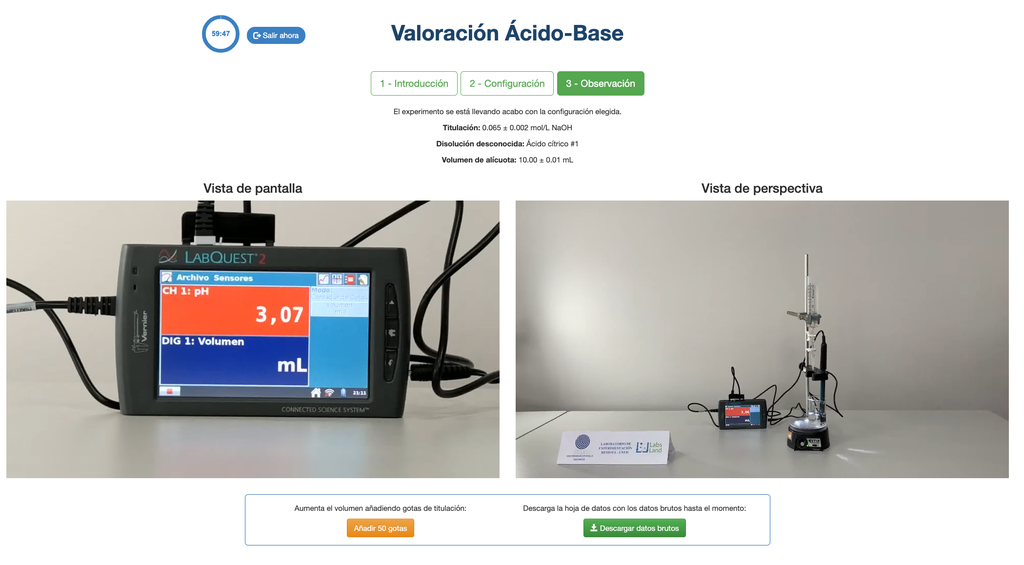
Titration Acido-Basique I
Résumé
Effectuez une titration acido-basique pour déterminer la concentration d'une solution inconnue d'acide citrique en utilisant un titrant d'hydroxyde de sodium. Un capteur de pH numérique est toujours disponible et un indicateur de phénolphtaléine a été appliqué à la solution inconnue afin qu'une approche potentiométrique et colorimétrique puisse être utilisée. Un graphique en temps réel est également disponible.
Titration acido-basique
Les titrations sont une méthode volumétrique basée sur la mesure de la quantité d'un réactif de concentration connue (connu sous le nom de norme primaire) consommée par un échantillon de concentration inconnue appelé analyte.
La titration est effectuée en ajoutant le titrant à l'analyte à l'aide d'une burette, de manière à obtenir une substance chimiquement équivalente entre le titrant et l'analyte. Ceci est connu sous le nom de "point d'équivalence" et c'est une valeur théorique qui ne peut pas être déterminée expérimentalement.
L'estimation expérimentale de ce point est obtenue par une approximation connue sous le nom de "point final". Ceci est déterminé par un changement physique. Dans ce cas, le changement de couleur de la solution est obtenu après l'ajout d'une substance indicatrice : une substance qui change de couleur dans certaines plages de pH.
Pour la titration acido-basique, nous utilisons un indicateur de phénolphtaléine qui devient rose clair après un pH d'environ 8,4, une valeur très proche du point d'équivalence dans les titrations acido-basiques les plus courantes.
Approches colorimétrique vs potentiométrique
L'approche colorimétrique repose sur le changement de couleur fourni par l'indicateur de phénolphtaléine. L'approche potentiométrique repose plutôt sur l'augmentation du pH mesurée par le capteur numérique. Dans cette version du laboratoire de titration acido-basique, les deux approches peuvent être utilisées. Le capteur numérique est toujours disponible et ne peut pas être masqué.
Différences avec le laboratoire de titration acido-basique II
Dans cette version du laboratoire (Titration acido-basique I), vous pouvez réaliser la titration acido-basique pour une solution inconnue d'acide citrique. Dans l'autre version du laboratoire (voir Titration acido-basique II), vous pouvez réaliser la titration acido-basique pour une solution d'acide acétique à la place.
Cette version du laboratoire met l'accent sur les calculs mais n'a pas parmi ses objectifs pédagogiques les mesures visuelles de burette. L'autre version du laboratoire (voir Titration acido-basique II) met l'accent sur les mesures visuelles, et les étudiants doivent apprendre à lire correctement le ménisque de la burette.
De plus, dans cette version, il existe une expérience unique qui peut être utilisée pour les approches colorimétrique et potentiométrique. Dans l'autre version du laboratoire (voir Titration acido-basique II), il existe deux configurations différentes disponibles, dont l'une où le capteur numérique est masqué afin que les étudiants ne puissent se fier qu'au changement de couleur.
Loi de Boyle
Résumé
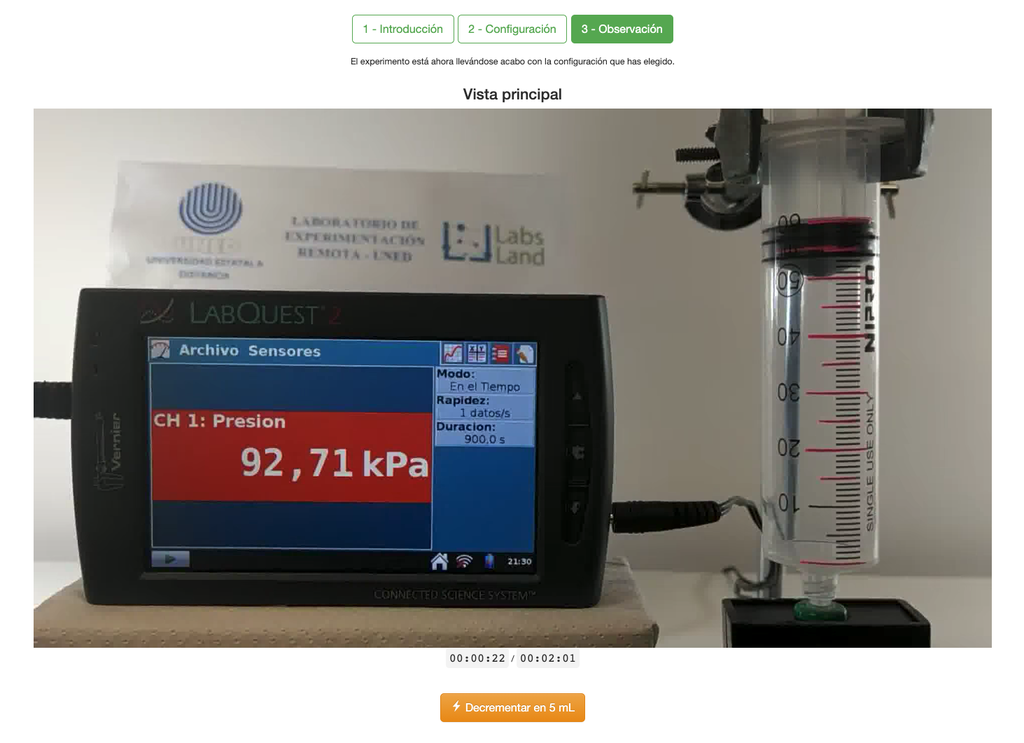
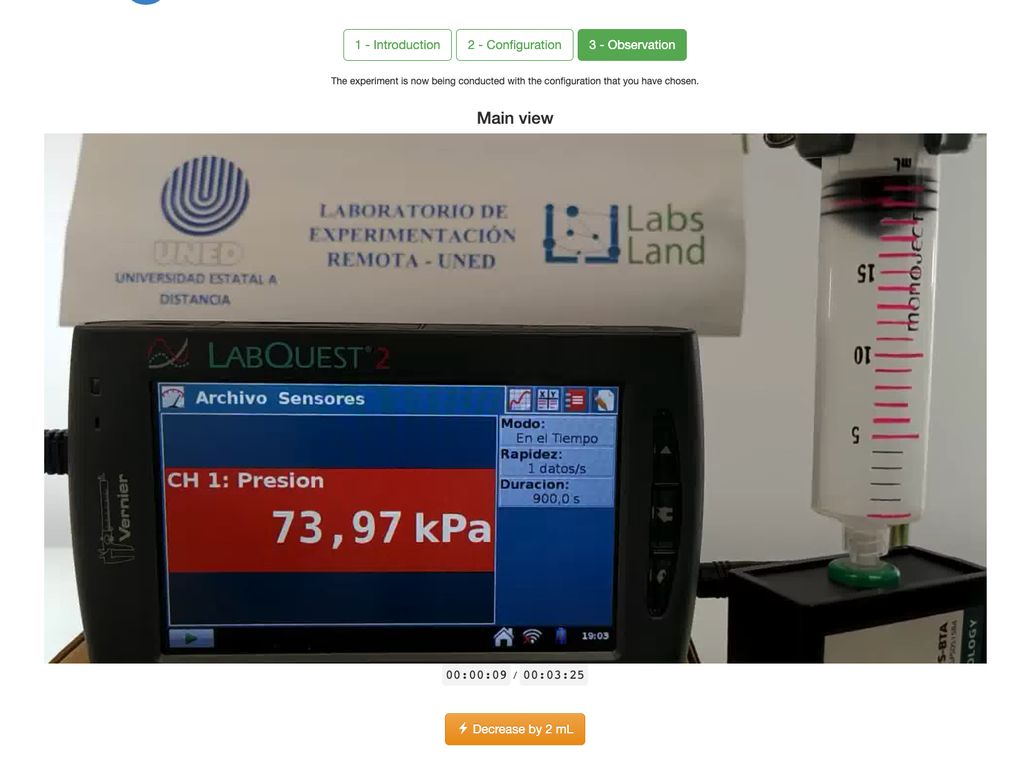
Le laboratoire de la loi de Boyle permet aux étudiants de déterminer la relation entre la pression et le volume d'un gaz à température ambiante et constante. Les étudiants peuvent choisir entre deux seringues de volumes différents et mesurer la pression du gaz en réduisant le volume. L'expérience est reflétée dans une analyse graphique sous la forme d'une isotherme. De cette manière, ils peuvent vérifier la loi de Boyle et apprendre le comportement des gaz de manière pratique et accessible.
Loi de Boyle
La loi de Boyle stipule qu'à température constante, le volume d'un gaz est inversement proportionnel à sa pression. Cela signifie que lorsque la pression d'un gaz augmente, son volume diminue, et vice versa. La loi de Boyle peut être exprimée mathématiquement comme suit :
V ∝ 1/P
Où V est le volume du gaz et P est la pression du gaz.
Le laboratoire de la loi de Boyle permet aux étudiants de mettre cette loi en pratique et de la vérifier dans un contexte expérimental. En mesurant le volume et la pression du gaz à différents moments, ils peuvent tracer un graphique isotherme qui montre comment le volume du gaz change en fonction de sa pression. Si le graphique isotherme correspond à la loi de Boyle, alors les étudiants ont vérifié expérimentalement la loi.
Réaliser des expériences comme celle-ci est une excellente façon d'apprendre le comportement des gaz et comment différentes variables sont liées. De plus, les expériences pratiques peuvent être plus accessibles et mémorables pour les étudiants que simplement lire sur la loi dans un manuel. Le graphique isotherme visualise clairement le comportement du gaz et vérifie si les prédictions de la loi de Boyle sont respectées.
Application dans l'enseignement secondaire et universitaire
Le laboratoire de la loi de Boyle est généralement appliqué dans des cours de sciences au niveau du lycée et dans des cours de chimie au niveau universitaire. Au niveau du lycée, le laboratoire peut être appliqué dans un cours de sciences où les concepts de base de la chimie et de la physique, tels que la pression et le volume des gaz, sont étudiés. À l'université, le laboratoire de la loi de Boyle peut être appliqué dans un cours de chimie plus avancé où l'étude des gaz et de leur comportement est approfondie.
Objectifs
Un laboratoire de la loi de Boyle peut avoir différents objectifs éducatifs en fonction du niveau éducatif auquel il est appliqué. Voici quelques exemples d'objectifs qu'un laboratoire de la loi de Boyle peut avoir au niveau du lycée et de l'université :
Au niveau du lycée :
- Les étudiants comprennent la loi de Boyle et son importance dans la physique des gaz.
- Les étudiants pratiquent des compétences expérimentales et d'observation.
- Les étudiants développent des compétences en analyse et représentation de données.
- Les étudiants comprennent la relation entre la température, la pression et le volume des gaz.
Au niveau universitaire :
- Les étudiants connaissent la loi de Boyle et son importance dans la physique des gaz.
- Les étudiants démontrent des compétences expérimentales et d'observation au laboratoire.
- Les étudiants appliquent des concepts théoriques de la physique des gaz dans des situations pratiques.
- Les étudiants développent des compétences en analyse et représentation de données dans un contexte scientifique.
- Les étudiants comprennent comment la température, la pression et le volume des gaz sont liés dans différentes situations.
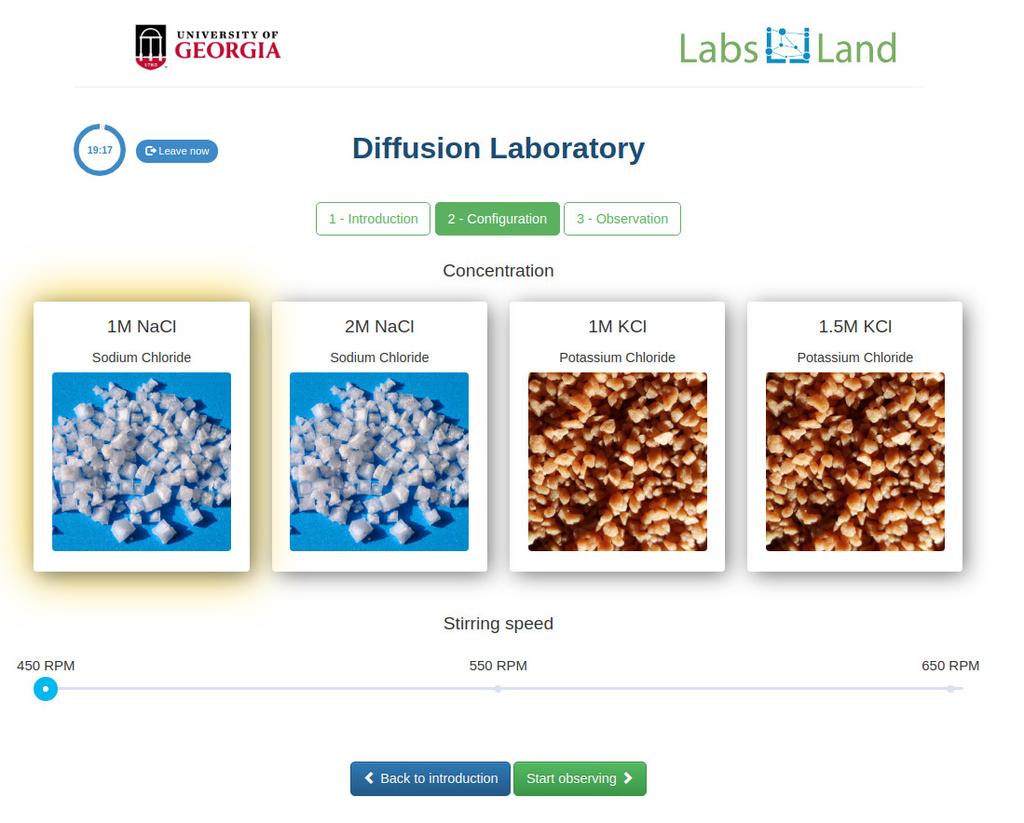
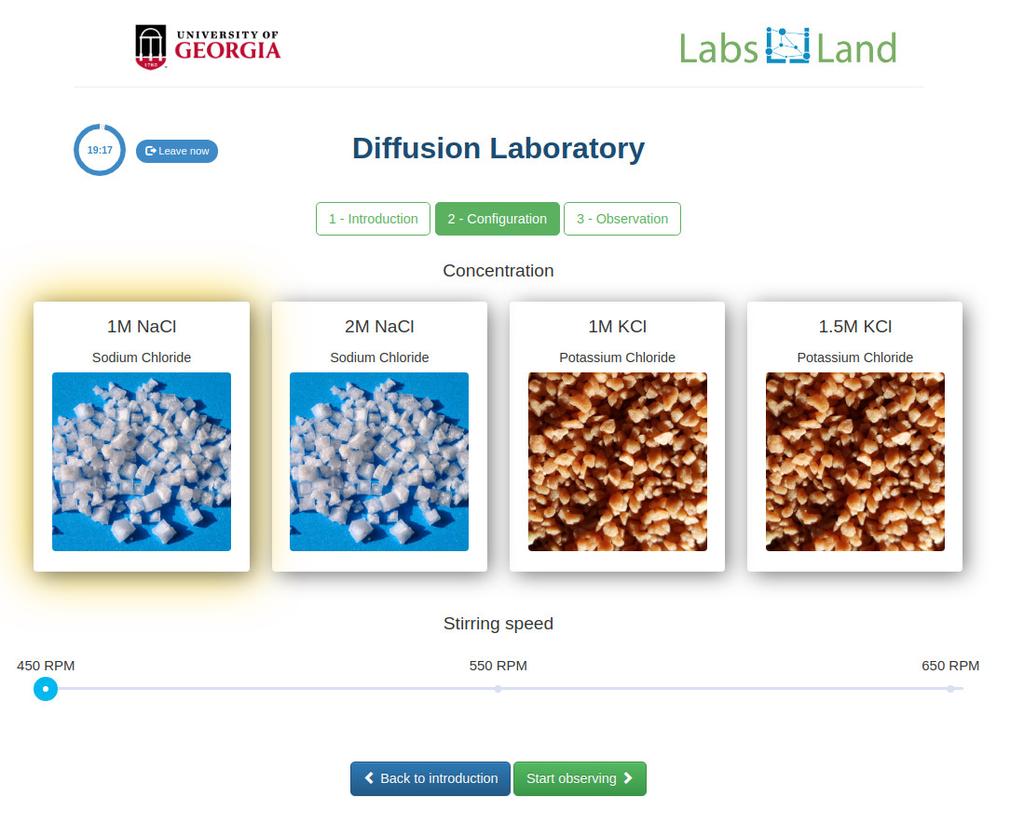
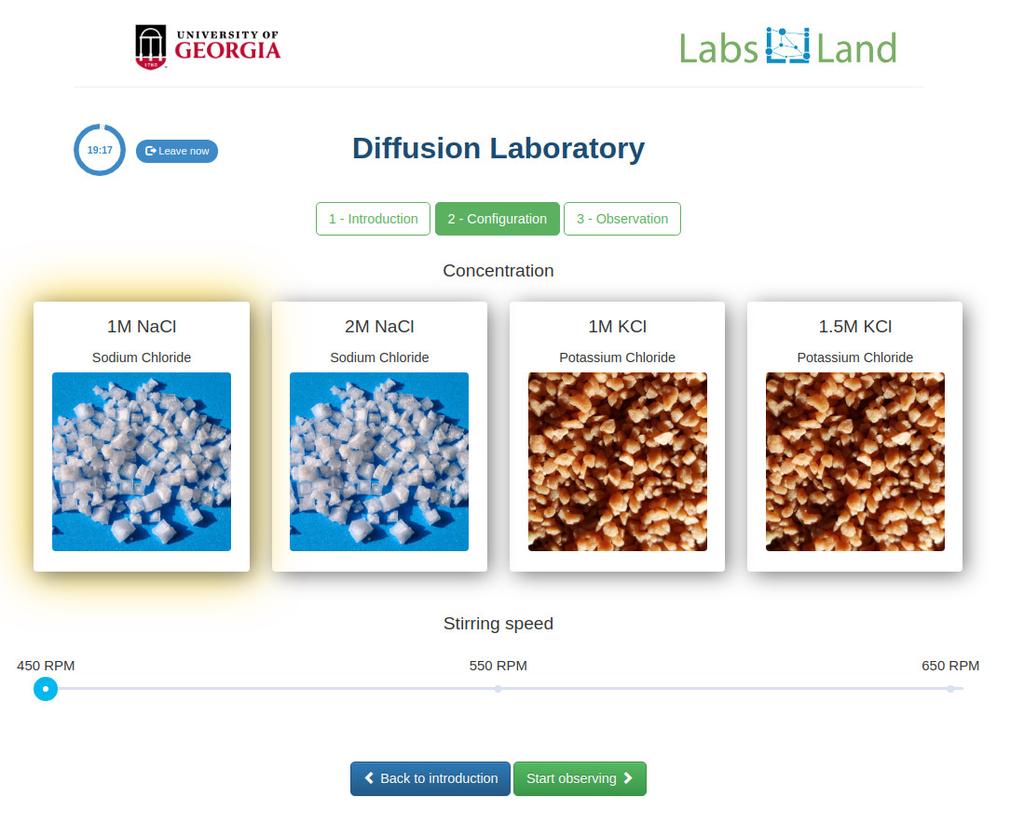
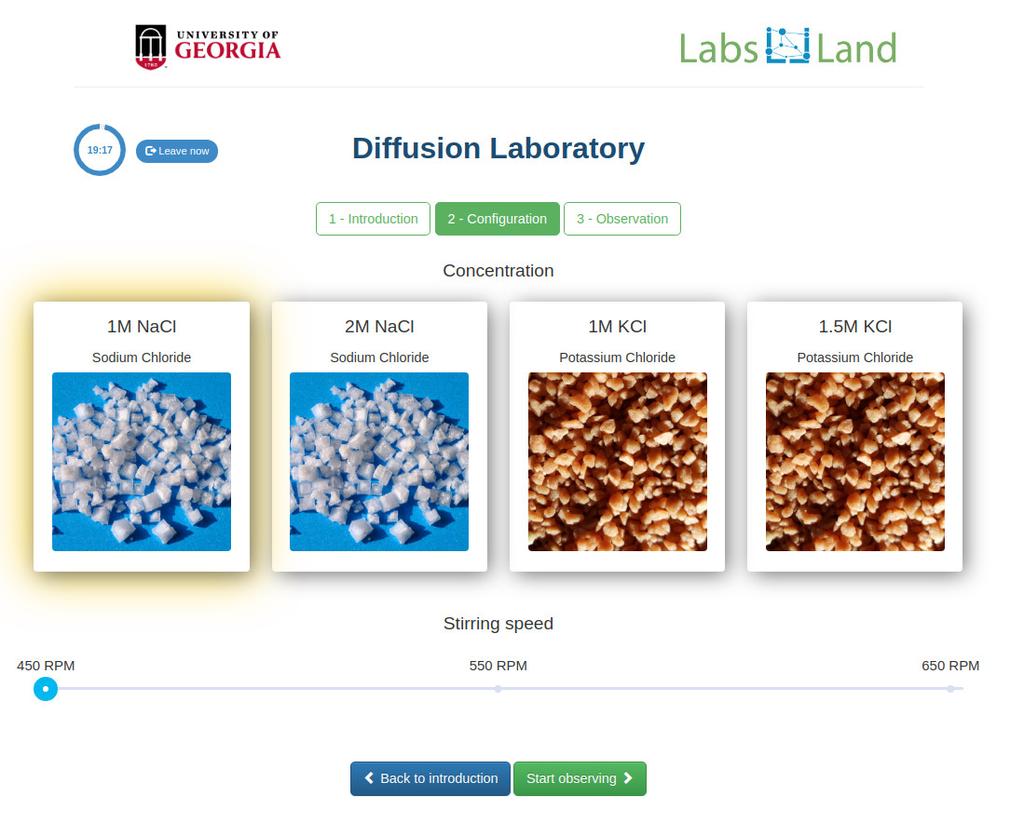
Diffusion laboratory - basic
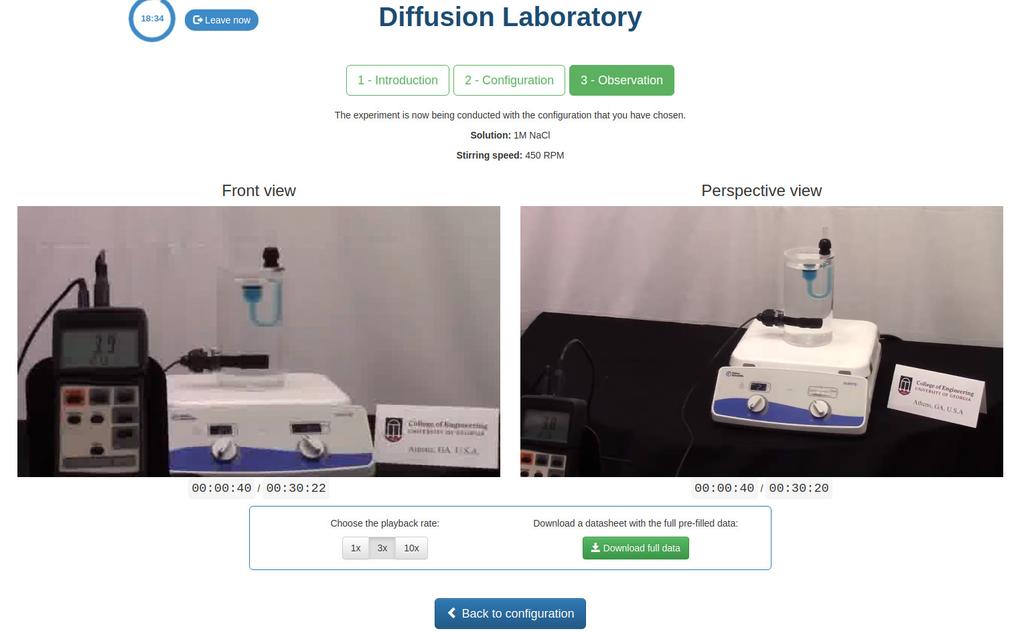
Diffusion laboratory - data
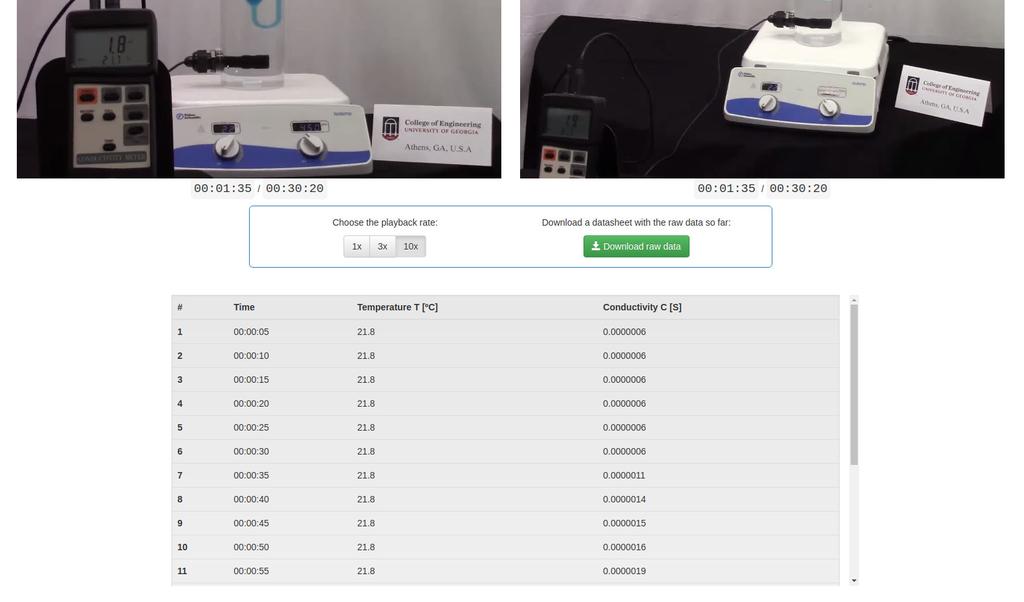
Diffusion laboratory - full
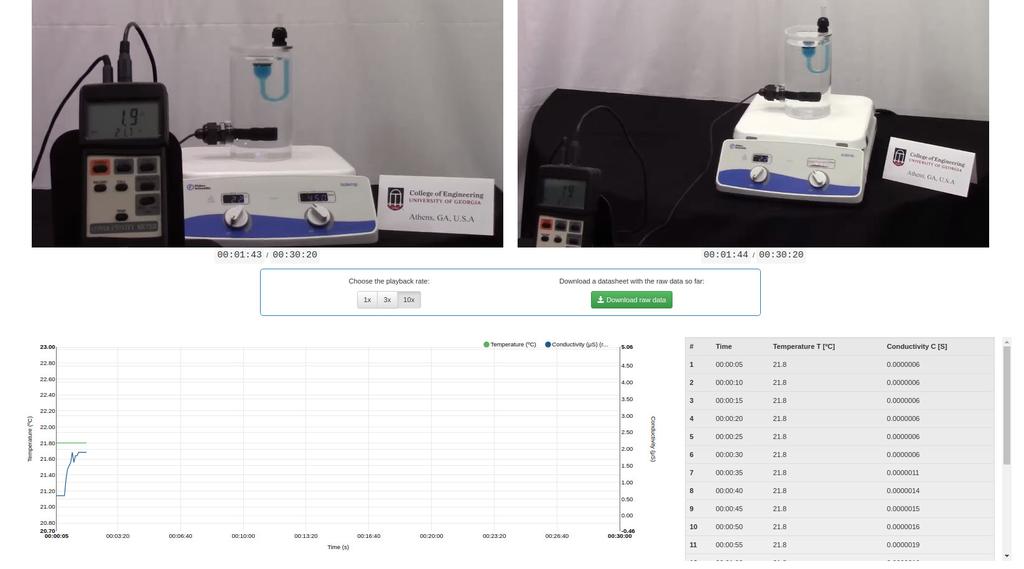
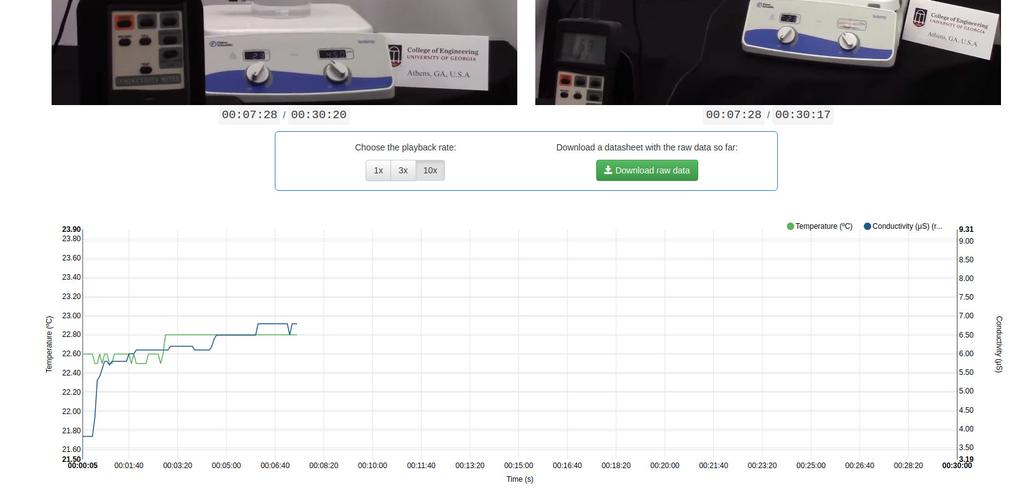
Diffusion laboratory - plot
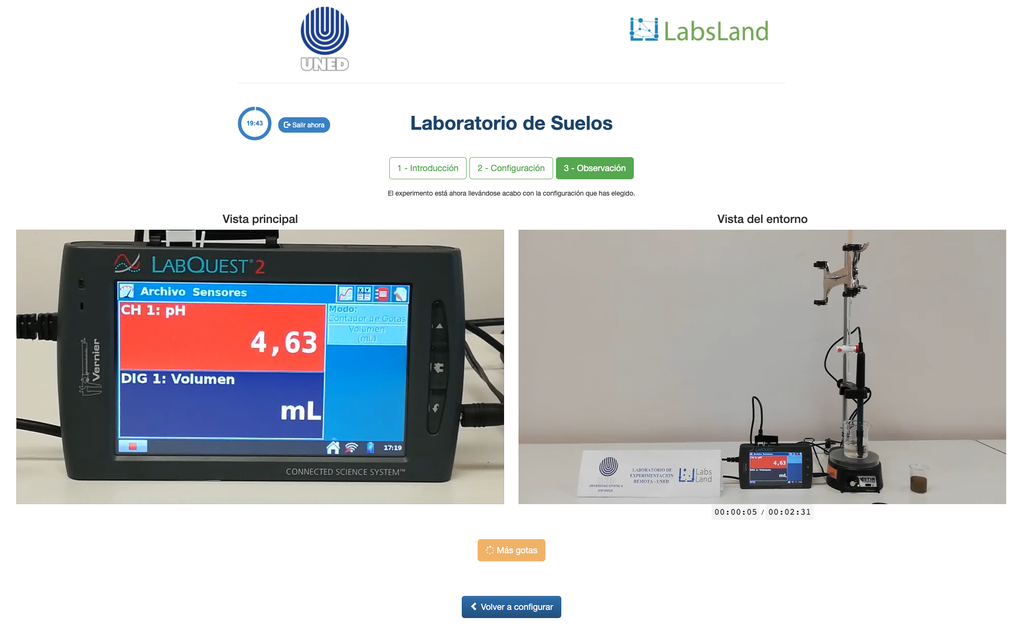
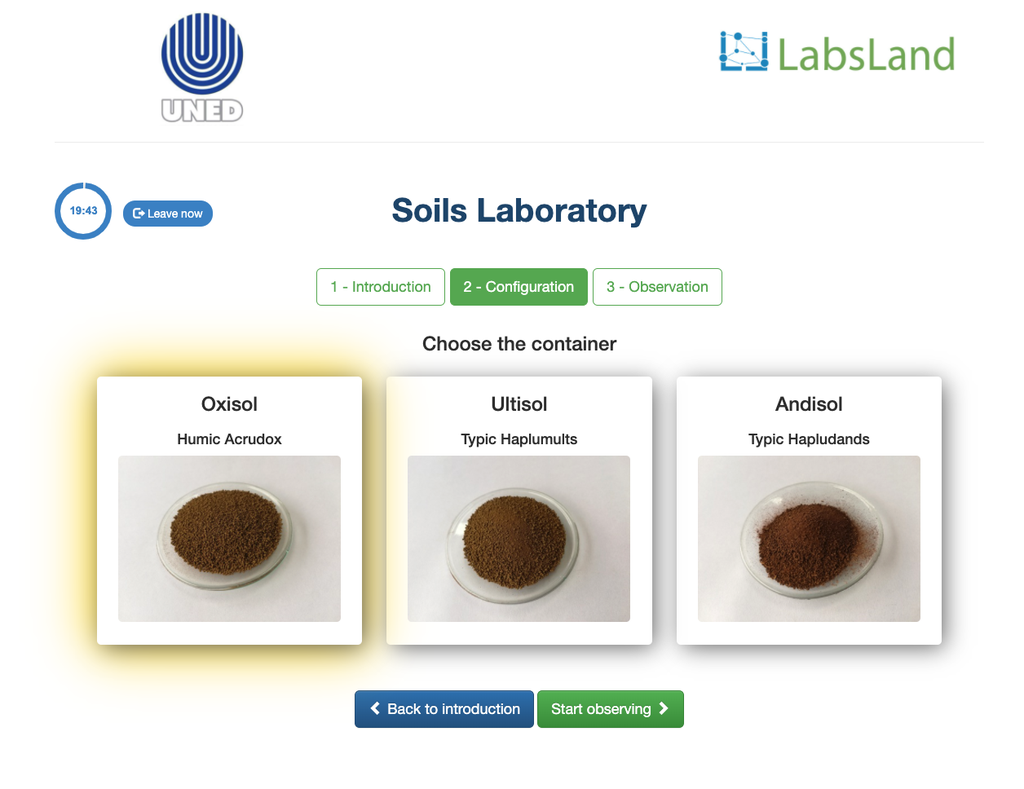
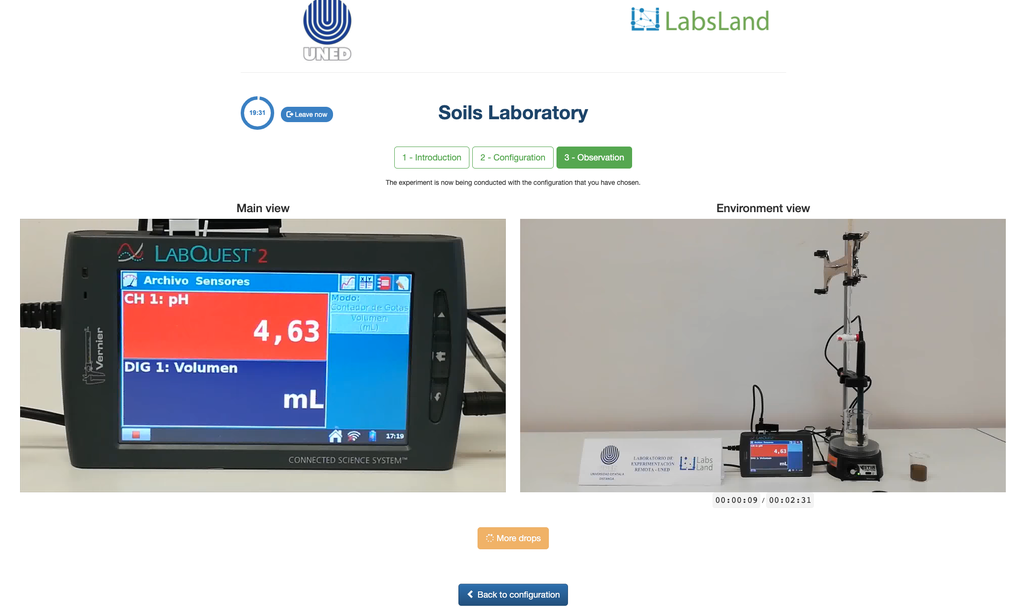
Acidité échangeable des sols
L'acidité des sols peut se produire en raison de divers processus qui favorisent une réduction du pH. Ces processus se produisent naturellement ou par l'action humaine. Les principales sources d'acidité du sol sont associées aux ions hydrogène (H+) et aux ions aluminium (Al+3) dans la solution du sol. L'acidité échangeable est déterminée par l'utilisation de solutions de sels neutres tels que le chlorure de potassium (KCl). Les ions acides (aluminium et hydronium) qui sont retenus dans la fraction colloïdale du sol, en présence d'un ion déplacé (K+), entrent dans la solution du sol. Par la suite, cette solution est titrée avec une solution d'hydroxyde de sodium de concentration exacte pour atteindre le dernier point de la réaction de neutralisation en utilisant la phénolphtaléine comme indicateur.

Loi de Gay-Lussac
La loi de Gay-Lussac nous permet d'étudier le comportement des gaz et est souvent étudiée en physique et en chimie. Elle relie la pression d'un gaz à sa température, tandis que d'autres paramètres tels que le volume et la quantité restent constants.
Il existe différentes manières de vérifier la loi de Gay-Lussac. Dans cette expérience, nous allons vérifier que, pour une quantité donnée de gaz, la pression est directement proportionnelle à la température.
Radioactivité
Résumé
Le montage, utile pour les écoles et les universités, comprend un compteur Geiger qui peut mesurer le nombre de collisions de particules détectées. L'utilisateur peut choisir parmi différentes sources radioactives, ainsi qu'un absorbeur à placer entre la source radioactive et la sonde. De plus, d'autres paramètres que les utilisateurs peuvent modifier sont la distance et le nombre de tests. Cela permet une large gamme d'expériences et d'opportunités d'apprentissage.
Radioactivité
La radioactivité est le processus par lequel un noyau atomique perd de l'énergie en émettant des particules et des radiations. Cela peut se produire naturellement dans certains éléments ou artificiellement grâce à l'utilisation de réactions nucléaires. Dans le contexte de la physique à l'école et à l'université, l'étude de la radioactivité peut fournir des informations précieuses sur la nature fondamentale de la matière et les lois de la physique.
Une expérience courante dans ce domaine est la mesure de la radioactivité à l'aide d'un compteur Geiger. Cet instrument est capable de détecter l'émission de particules provenant d'une source radioactive, permettant aux étudiants de comprendre les principes de base des radiations et leurs effets sur la matière. En variant le type de source radioactive, la distance entre la source et le détecteur et le type de matériau absorbeur placé entre les deux, les étudiants peuvent explorer une large gamme de phénomènes et approfondir leur compréhension des principes sous-jacents.
En plus de sa valeur éducative, l'étude de la radioactivité a également des applications pratiques dans des domaines tels que la médecine, la production d'énergie et la protection de l'environnement. En tant que tel, c'est un sujet important à apprendre pour les étudiants, à la fois pour son intérêt intrinsèque et pour ses nombreuses applications dans le monde réel.
Applications pratiques de la radioactivité
Une des applications les plus courantes de la radioactivité est dans le domaine de la médecine. Les isotopes radioactifs sont utilisés dans les techniques d'imagerie médicale telles que les scanners TEP et TEMP, qui permettent aux médecins de voir à l'intérieur du corps et de diagnostiquer des maladies. Les isotopes radioactifs sont également utilisés dans les traitements contre le cancer, tels que la radiothérapie, où ils servent à tuer les cellules cancéreuses.
La radioactivité est aussi utilisée dans des industries comme l'exploration pétrolière et gazière où elle sert à mesurer la perméabilité des formations rocheuses et le flux de fluides à travers elles. Les isotopes radioactifs sont aussi utilisés dans les détecteurs de fumée et dans la production de montres et d'instruments lumineux.
Globalement, la radioactivité a une grande variété d'applications dans des domaines tels que la médecine, l'industrie, et même les produits de consommation courante. Elle continue d'être un domaine d'étude important en physique et dans d'autres sciences, et ses utilisations continuent de s'étendre à mesure que de nouvelles technologies sont développées.
Expériences de radioactivité à l'école et à l'université
L'utilisation d'un compteur Geiger dans une expérience de radioactivité offre une large gamme de possibilités. En variant les émetteurs et les absorbeurs de radiation, les étudiants peuvent observer les effets de différentes sources et matériaux sur les collisions de particules détectées. Cela peut aider les étudiants à comprendre les propriétés de la radioactivité et le comportement de différentes particules.
De plus, des expériences impliquant la détermination du type de particule émise peuvent être menées en observant si la particule est absorbée ou non. En plaçant différents absorbeurs entre la source et la sonde, les étudiants peuvent déterminer les propriétés des particules émises et approfondir leur compréhension de la radioactivité.
Enfin, des expériences impliquant la détermination de la forme géométrique de l'émission de radioactivité peuvent également être menées en utilisant un compteur Geiger. En mesurant soigneusement les collisions de particules détectées à différentes distances, les étudiants peuvent obtenir des informations sur la distribution spatiale de la radioactivité. Cela peut aider les étudiants à comprendre les principes fondamentaux de la radioactivité et ses applications dans le monde réel.
Objectifs d'apprentissage potentiels
Les objectifs potentiels des activités réalisées avec le laboratoire sont les suivants :
- Comprendre les propriétés et le comportement des émissions radioactives.
- Conduire des expériences pour mesurer les effets des radiations sur divers matériaux.
- Déterminer le type de radiation émise par une source radioactive.
- Comprendre les principes de sécurité et de manipulation des radiations.
- Étudier les applications de la radioactivité dans des domaines tels que la médecine, l'industrie et la recherche.
- Comprendre les principes des compteurs Geiger et leur utilisation pour mesurer la radioactivité.
- Comprendre le développement historique du concept de radioactivité et sa découverte.
- Explorer les implications éthiques de l'utilisation de matériaux radioactifs.

Spectroscopie
Ce laboratoire ultra concurrent est basé sur une pratique expérimentale concernant la spectroscopie des rayons X en utilisant un appareil de marque LEYBOLD installé dans un laboratoire d'instrumentation radiologique à l'Université Nationale du Costa Rica (Universidad Nacional de Costa Rica), situé dans le bâtiment de Physique Médicale Appliquée.
L'assemblage consiste en un tube à rayons X avec une anode en or (Au), ainsi qu'un détecteur à scintillation configuré avec un préamplificateur et un numériseur permettant de traiter les informations provenant des mesures effectuées par le détecteur via un logiciel.
Le test vise à caractériser le faisceau de la source de rayonnement par le calcul expérimental du spectre du faisceau de rayons X produit dans le tube, en plus de générer des notions de base sur l'instrumentation radiologique et sur la manière dont la variation de ses paramètres est utilisée dans les applications industrielles et médicales.











