Obtén acceso a LCAL2003: Chemistry labs (ultraconcurrent)
Por sólo:
9,99 US$Un pago
6 meses de acceso
Métodos de pago compatibles:
- DigiKey (No disponible en todos los países)
- Tarjeta de crédito o débito
- PayPal
Necesitas crear o usar una cuenta de LabsLand para continuar.
Acceso remoto a 12 laboratorios incluido:
¿Intentando comprar múltiples licencias para una clase? Contáctanos para descuentos por volumen
¿Qué es LabsLand?
LabsLand es la red global de laboratorios remotos.
El hardware es siempre real, no una simulación.
Controla el equipo real con cámaras a través de Internet.
Accede ahora. No necesitas esperar a que un equipo se envíe.
Sin costes ocultos: todo incluido. Ni accesorios ni costes de envío.
Muy fácil de usar: el equipamiento ya está funcionando.
Alquílalo sólo los meses que lo necesitas para tu aprendizaje.
¿Cómo funciona LabsLand?
LabsLand es la red global de laboratorios reales a través de Internet. Los estudiantes (de colegios, universidades y plataformas online) pueden acceder a laboratorios reales a través de Internet, usando su portatil, tablet o teléfono.
Los laboratorios pueden ser en tiempo real (Arduino, FPGAs...) ubicados en diferentes universidades en todo el mundo. En algunos campos (Física, Biología, Química), los laboratoriso son Laboratorios Diferidos, en los que la universidad ha grabado todas las potenciales combinaciones de lo que se puede hacer en el laboratorio (en algunos casos, varios miles de grabaciones) y ponerlo disponible en modo interactivo.
En todos los casos, el laboratorio es real (no simulado), y disponible a través de la Web (no necesitas obtener ningún hardware, gestionar envíos, etc.).
Comprueba cómo funciona un uso típico en el siguiente vídeo:
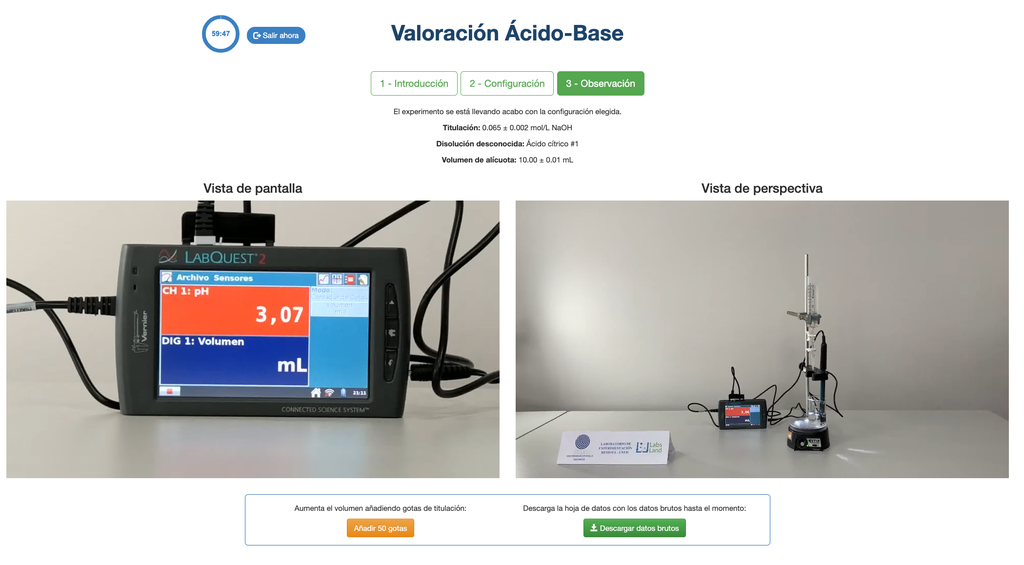
Valora. Ácido-Base II
Este laboratorio permite llevar a cabo una valoración ácido-base usando o bien la técnica potenciométrica o la técnica colorimétrica.
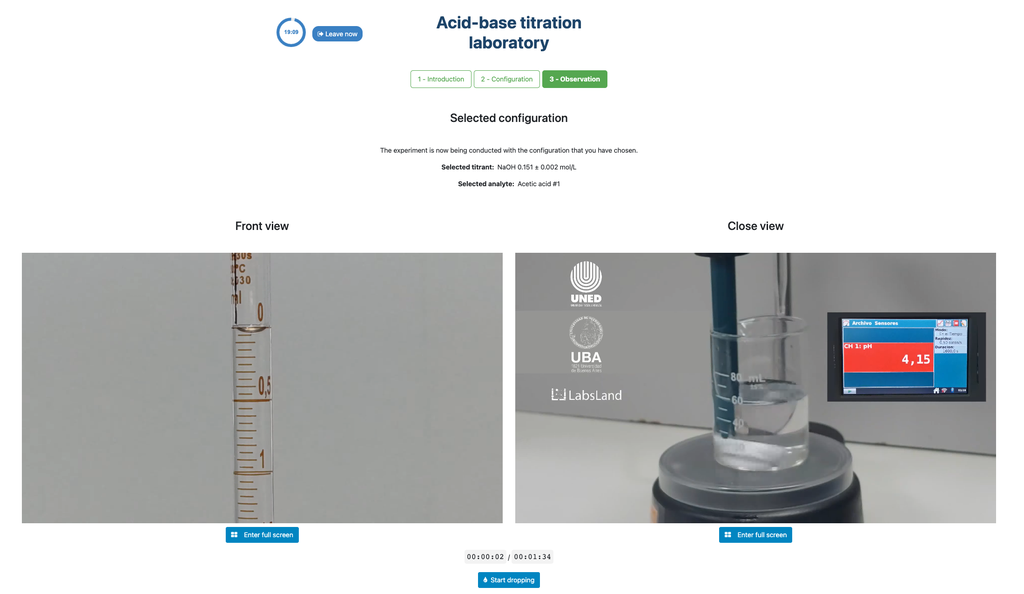
En el primer caso, tendrás acceso a un sensor de pH digital que podrás utilizar para determinar cuándo se ha neutrailzado la disolución desconocida (utilizando por tanto la técnica potenciométrica).
En el segundo caso, utilizarás la variación en el color debido al indicador de fenolftaleína para determinar cuándo se ha neutralizado la disolución desconocida (utilizando por tanto la técnica colorimétrica).
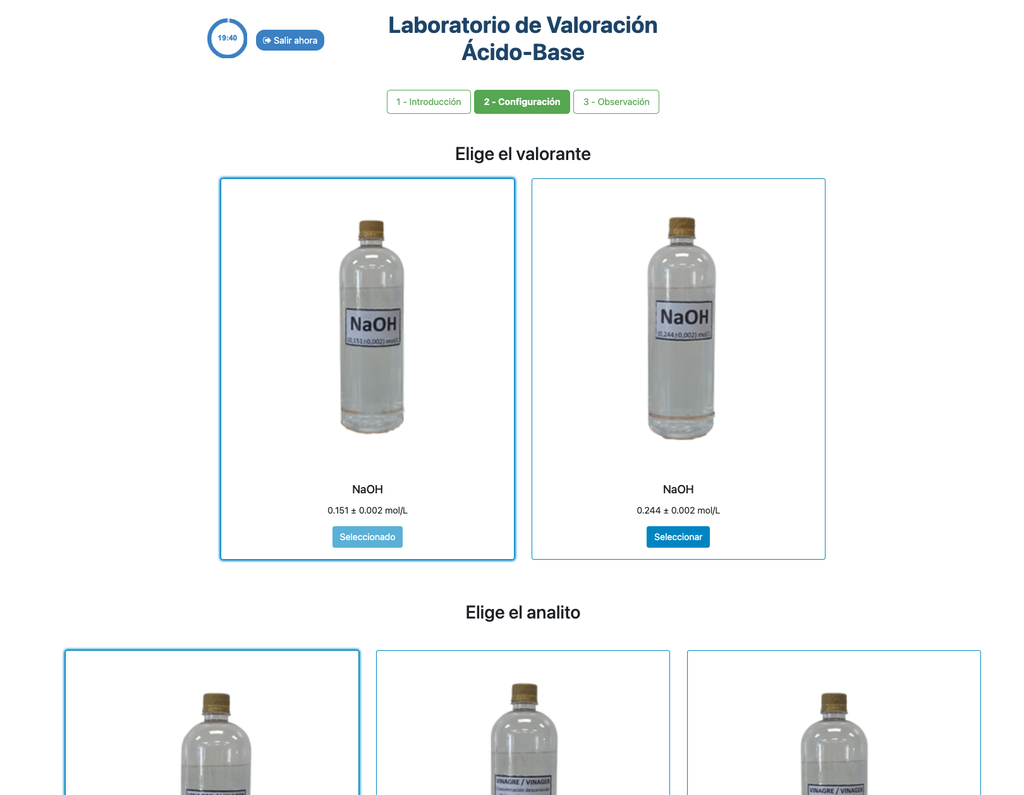
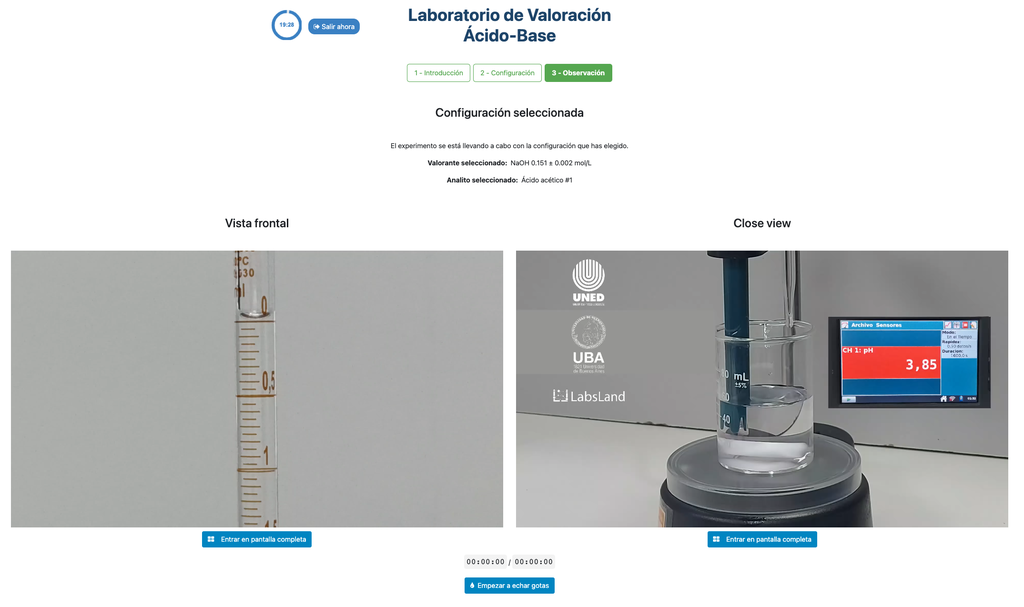
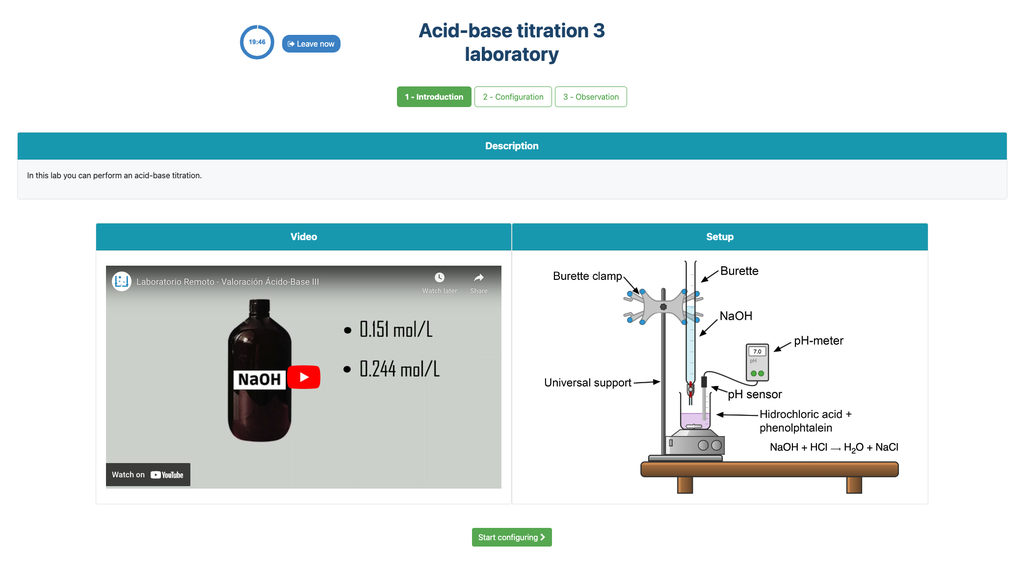
Valora. Ácido-Base III
Resumen
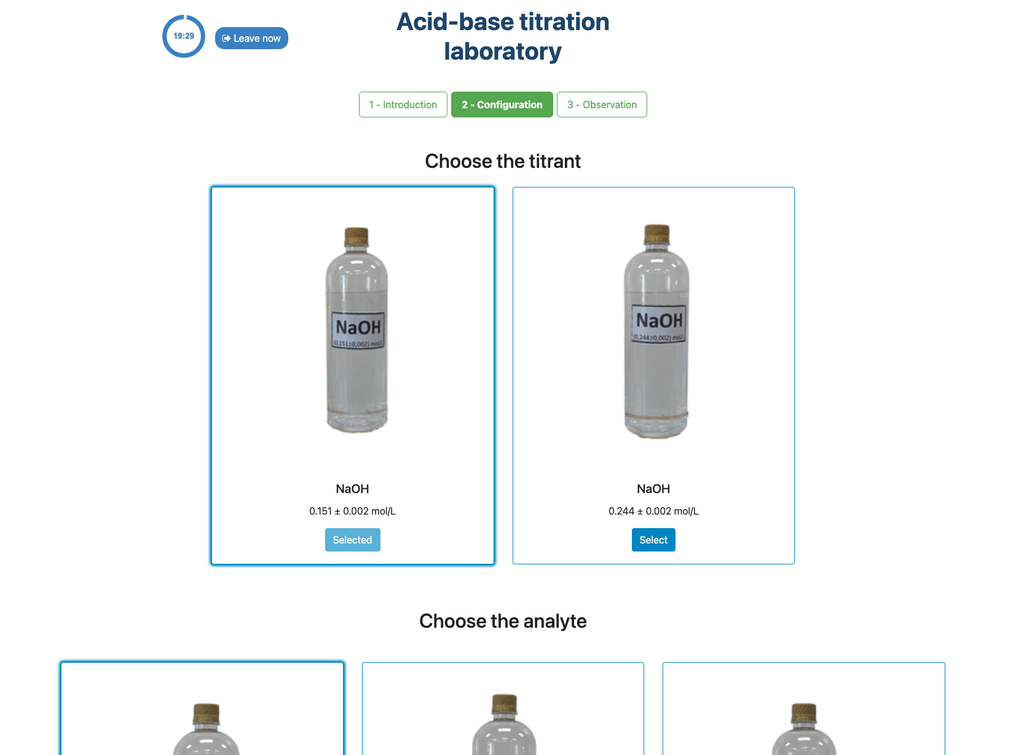
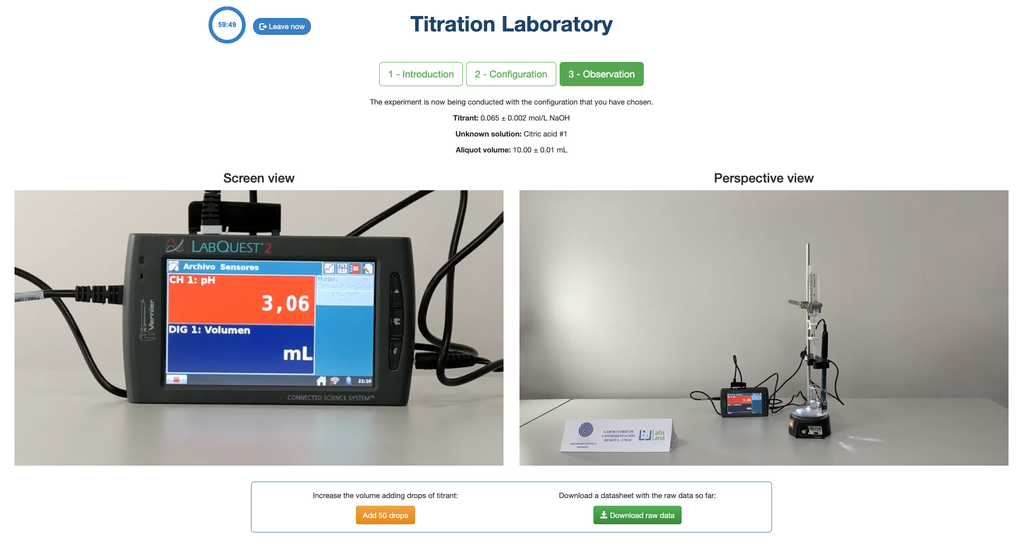
Realiza una titulación ácido-base para determinar la concentración de una solución desconocida de ácido clorhídrico utilizando un titulante de hidróxido de sodio. Este laboratorio pone énfasis en mediciones visuales que tratan con el menisco de la bureta y soporta dos configuraciones diferentes.
La primera es para un enfoque potenciométrico: tendrás acceso a un sensor de pH digital y puedes usarlo para determinar cuándo la solución desconocida ha sido neutralizada.
La segunda es para un enfoque colorimétrico: puedes confiar en el cambio de color debido a la presencia de un indicador de fenolftaleína, sin tener disponible un sensor de pH digital.
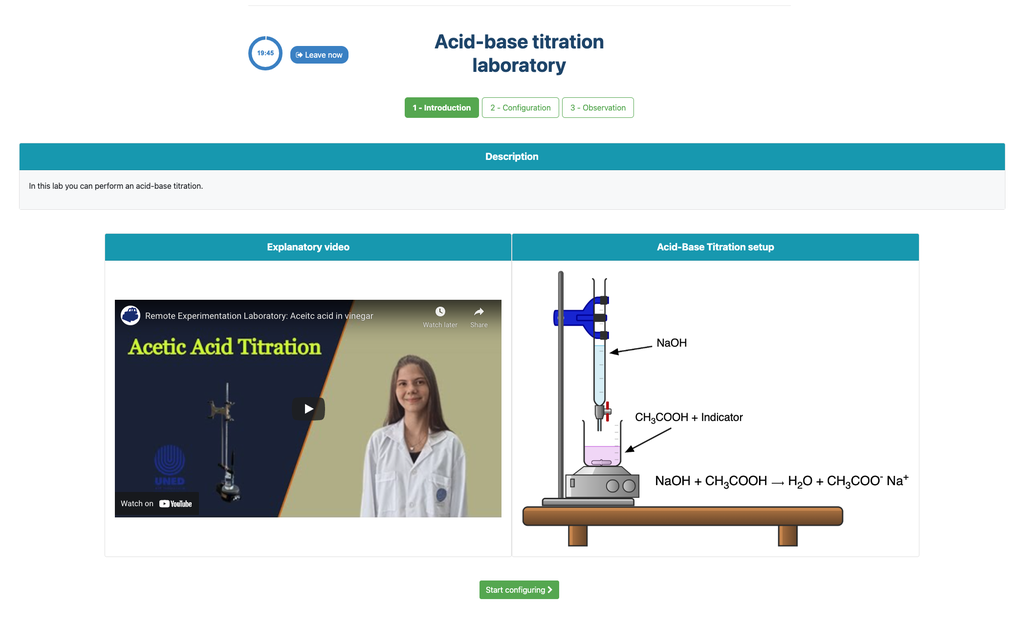
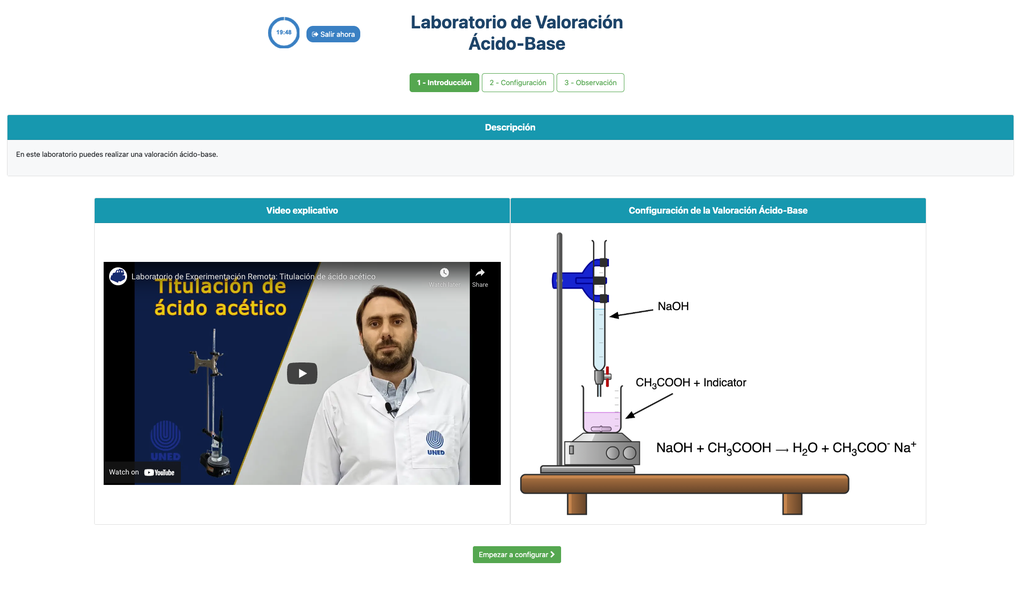
Titulación Ácido-Base
Las titulaciones son un método volumétrico que se basa en medir la cantidad de un reactivo de concentración conocida (conocido como estándar primario) que es consumido por una muestra de concentración desconocida, conocida como analito.
La titulación se lleva a cabo añadiendo el titulante al analito mediante una bureta, con el fin de obtener una sustancia químicamente equivalente entre el titulante y el analito. Esto se conoce como el "punto de equivalencia" y es un valor teórico que no puede determinarse experimentalmente.
La estimación experimental de este punto se obtiene a través de una aproximación conocida como "punto final". Esto se determina mediante un cambio físico. En ese caso, el cambio de color de la solución se logra después de añadir una sustancia indicadora: una sustancia que cambia de color en ciertos rangos de pH.
Para la titulación ácido-base utilizamos un indicador de fenolftaleína que se vuelve de un rosa claro después de un pH de alrededor de 8.4, que es un valor muy cercano al punto de equivalencia en las titulaciones ácido-base más comunes.
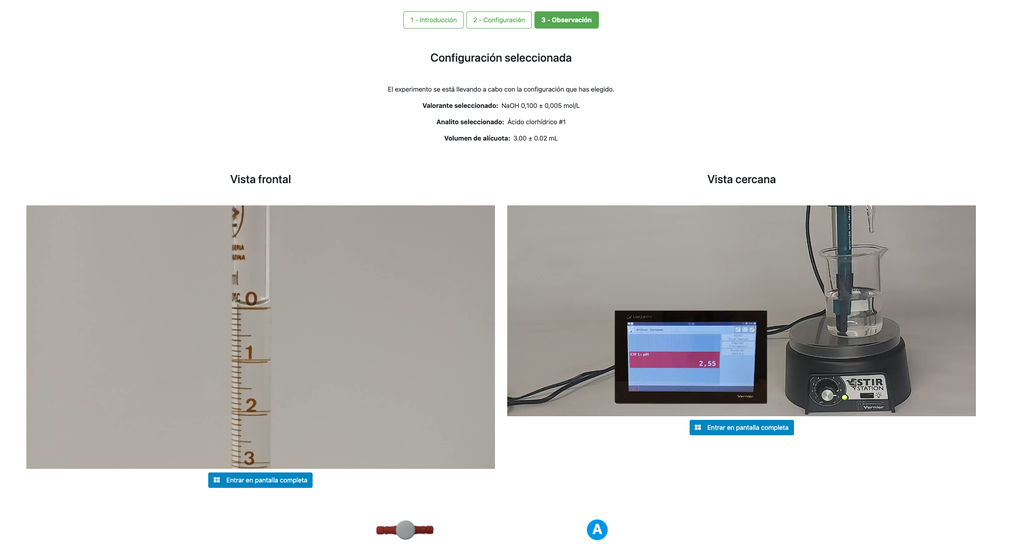
Alternativamente, en la configuración potenciométrica, se puede usar un sensor de pH digital para determinar el “punto de equivalencia”.
Enfoque Colorimétrico vs Potenciométrico
El enfoque colorimétrico se basa en el cambio de color proporcionado por el indicador de fenolftaleína. El enfoque potenciométrico se basa en cambio en el aumento del pH medido por el sensor digital. En esta versión del laboratorio hay dos configuraciones diferentes disponibles, una para cada enfoque. En la configuración colorimétrica los estudiantes quizás no vean el sensor de pH digital.
Diferencias con los otros laboratorios de titulación En esta versión del laboratorio (Titulación Ácido-Base II) puedes realizar la titulación ácido-base para una solución desconocida de ácido clorhídrico. En otras versiones del laboratorio puedes realizar la titulación ácido-base para una solución de ácido cítrico (Titulación Ácido-Base I) y ácido acético (Titulación Ácido-Base II).
Tanto esta versión del laboratorio (Titulación Ácido-Base III) como la Titulación Ácido-Base II hacen énfasis en mediciones visuales de la bureta, incluyendo la lectura adecuada del menisco en la bureta. La otra versión del laboratorio (ver Titulación Ácido-Base I) no hace énfasis en esto y se centra en los cálculos.
Además, en estas versiones puedes elegir entre dos configuraciones diferentes: una para el enfoque potenciométrico y otra para el enfoque colorimétrico. La configuración para el enfoque colorimétrico no muestra el sensor de pH. En otra versión del laboratorio (ver Titulación Ácido-Base I) hay una única configuración y el sensor siempre se muestra.
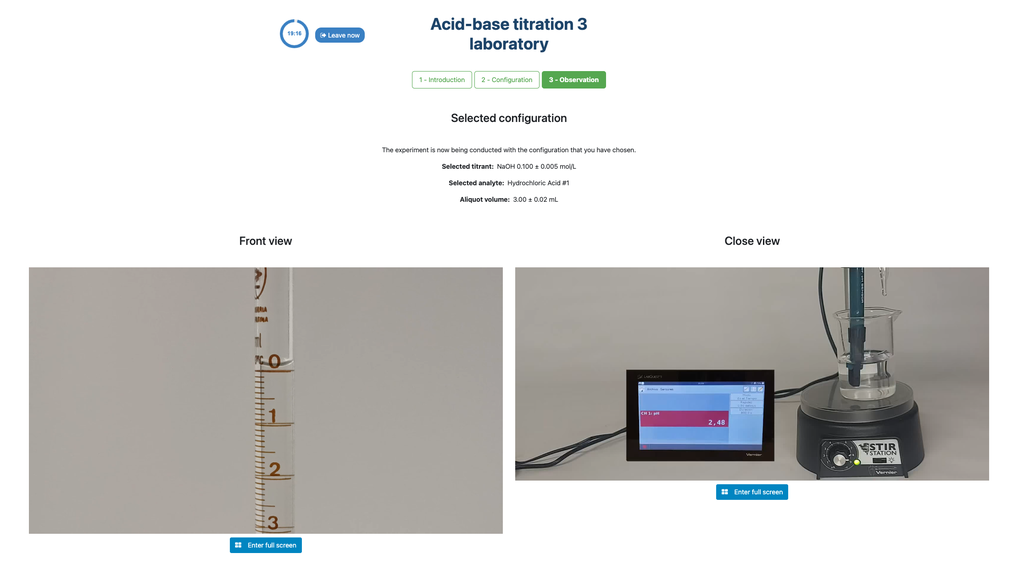
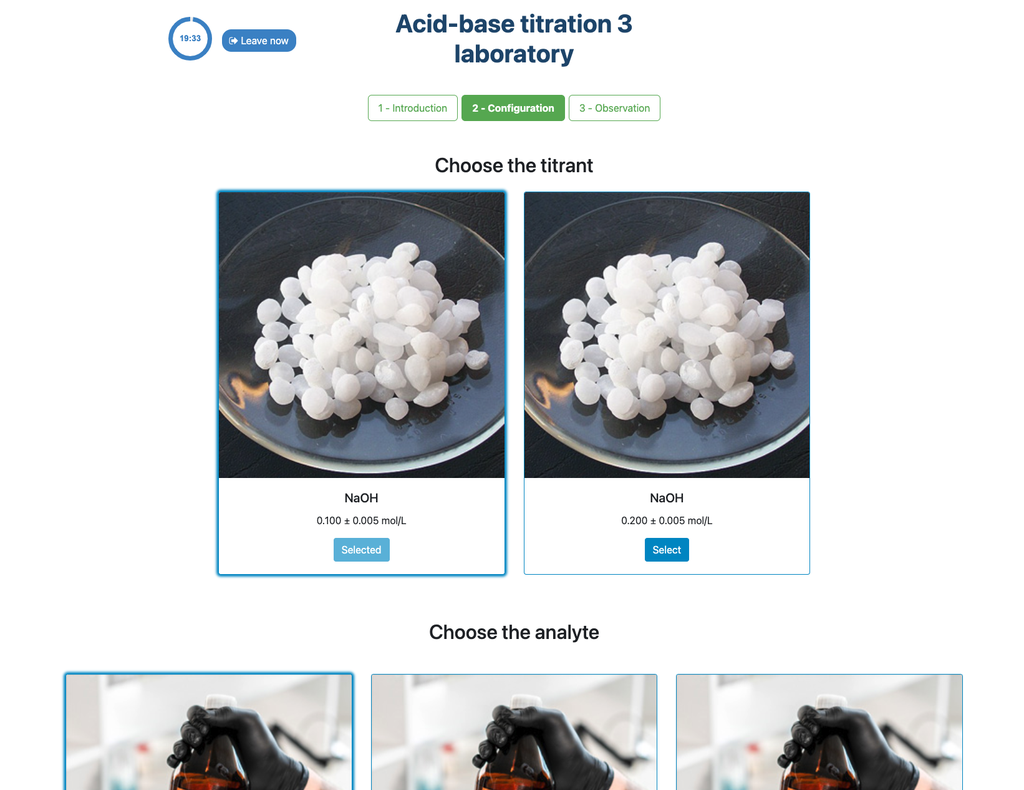
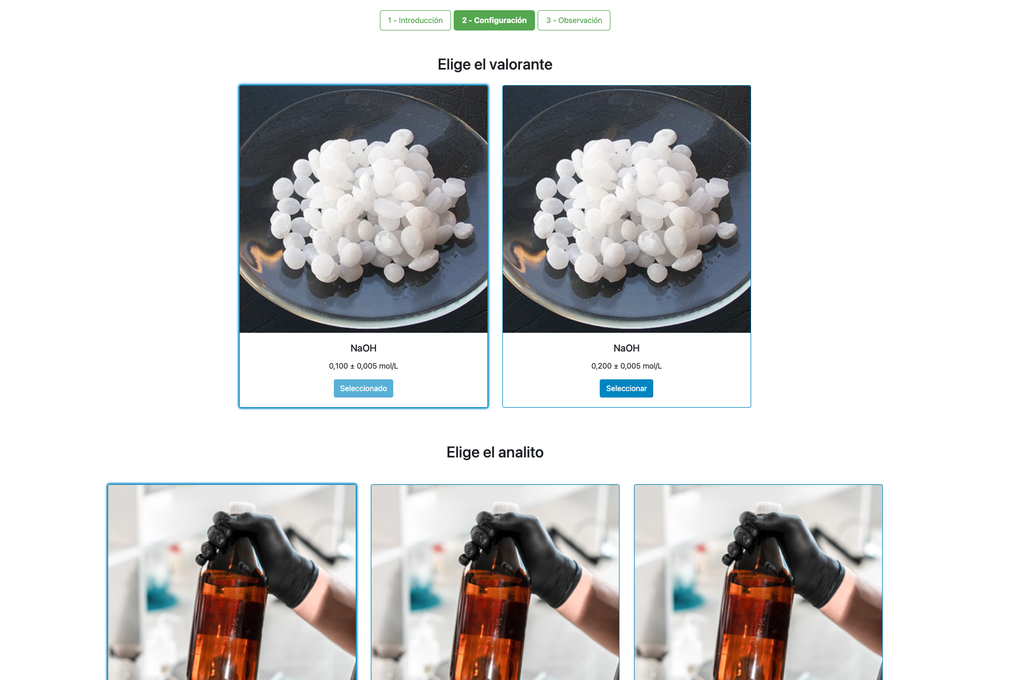

Valora. Ácido-Base I
Las valoraciones o titulaciones (término adaptado del inglés) son un método volumétrico basado en la medición de la cantidad de un reactivo de concentración conocida – llamada sustancia patrón- que se consume por una muestra incógnita llamada analito.
La titulación se realiza añadiendo el valorante, titulante o sustancia patrón desde una bureta sobre el analito, con el fin de lograr una cantidad químicamente equivalente entre el titulante y el analito. A esto se le llama “punto de equivalencia” y se trata de un valor teórico que no se puede determinar experimentalmente.
La estimación experimental de este punto se obtiene mediante una aproximación llamada “punto final”, el cual, se logra determinar por un cambio físico, en este caso, un cambio en el color de la disolución que se consigue al añadir una sustancia llamada indicador; una sustancia capaz de cambiar de color a ciertos rangos de pH.
Para la titulación (valoración) ácido-base, o de neutralización, se utiliza un indicador de fenolftaleína que genera un cambio de incoloro hasta un rosa tenue a un pH aproximado de 8,4, valor que se encuentra muy cerca del punto de equivalencia en las titulaciones ácido-base más típicas.
Ley de Boyle
Resumen
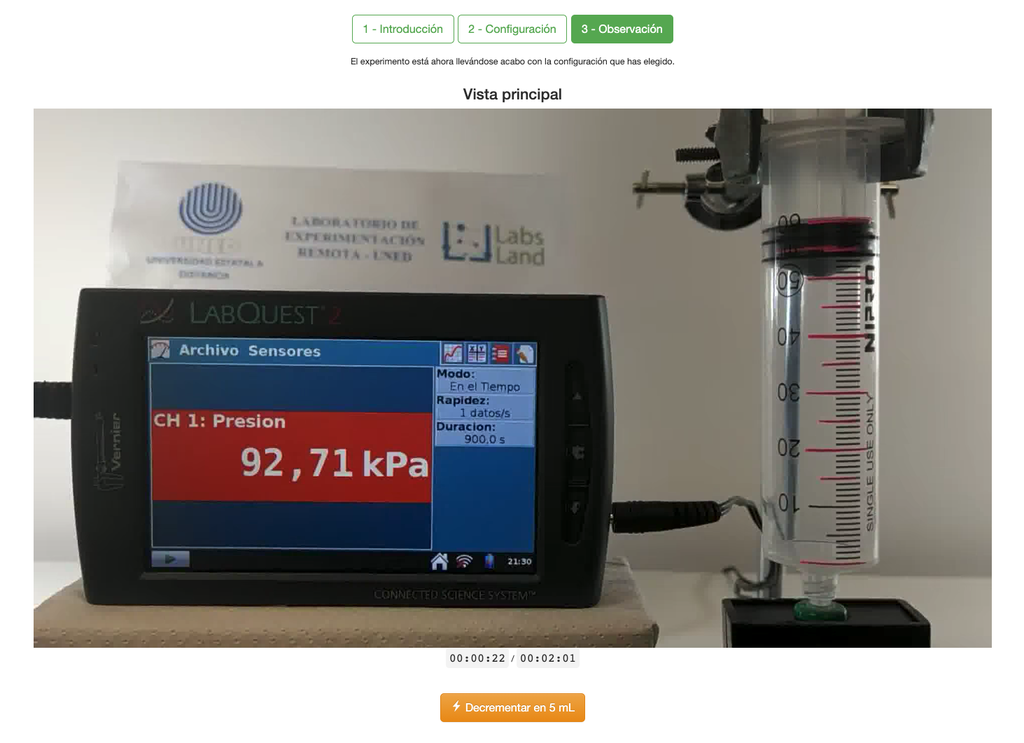
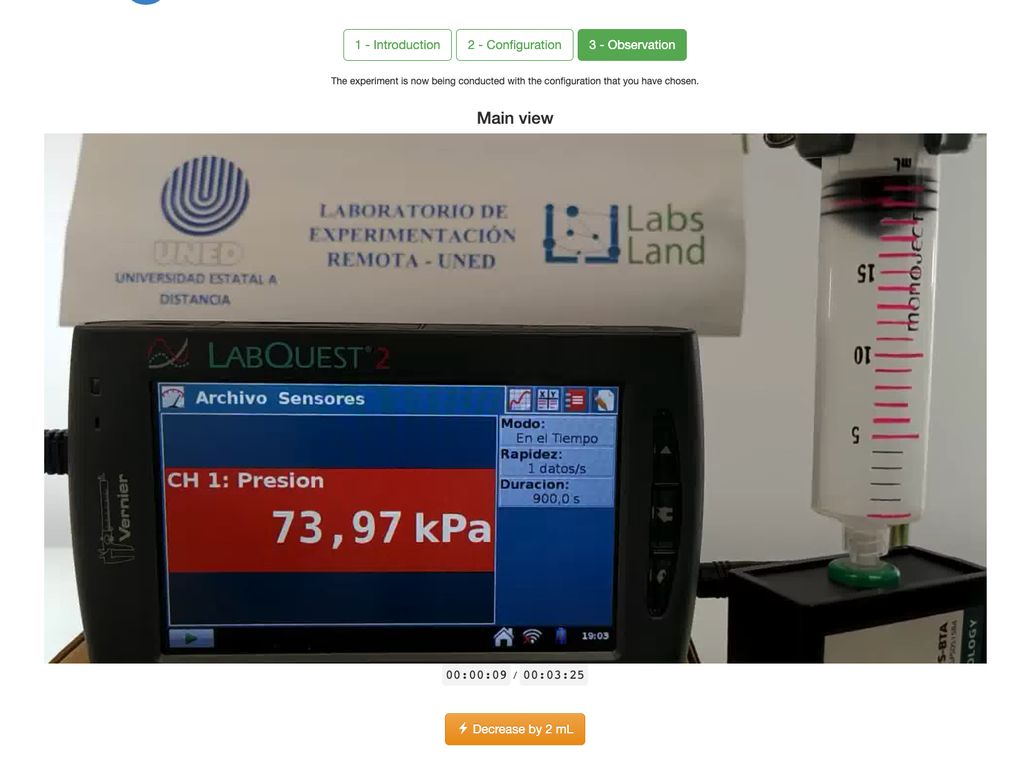
El laboratorio de la Ley de Boyle permite a los estudiantes determinar la relación entre la presión y el volumen de un gas a temperatura ambiente y constante. Los estudiantes pueden elegir entre dos jeringuillas de diferente volumen y medir la presión del gas a medida que van reduciendo el volumen. El experimento se refleja en un análisis gráfico en forma de isoterma. De esta manera, pueden verificar la Ley de Boyle y aprender sobre el comportamiento de los gases de una manera práctica y accesible.
Ley de Boyle
La Ley de Boyle establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a su presión. Esto significa que cuando aumenta la presión de un gas, su volumen disminuye y viceversa. La Ley de Boyle se puede expresar matemáticamente como:
V ∝ 1/P
Donde V es el volumen del gas y P es la presión del gas.
El laboratorio de la Ley de Boyle permite a los estudiantes poner en práctica esta ley y verificarla en un contexto experimental. Al medir el volumen y la presión del gas en diferentes momentos, pueden trazar una gráfica isoterma que muestre cómo cambia el volumen del gas en función de su presión. Si la gráfica isoterma se ajusta a la Ley de Boyle, entonces los estudiantes han verificado la ley de manera experimental.
Realizar experimentos como este es una excelente forma de aprender sobre el comportamiento de los gases y cómo se relacionan diferentes variables. Además, los experimentos prácticos pueden ser más accesibles y memorables para los estudiantes que simplemente leer sobre la ley en un libro de texto. La gráfica isoterma permite visualizar de manera clara el comportamiento del gas y verificar si se cumplen las predicciones de la Ley de Boyle.
Aplicación en educación secundaria y universitaria
El laboratorio de la Ley de Boyle suele aplicarse en cursos de ciencias en el nivel de colegio y en cursos de química en el nivel universitario. En el nivel de colegio, el laboratorio se puede aplicar en un curso de ciencias en el que se estudien los conceptos básicos de la química y la física, como la presión y el volumen de los gases. En la universidad, el laboratorio de la Ley de Boyle puede aplicarse en un curso de química más avanzado en el que se profundice en el estudio de los gases y su comportamiento.
Objetivos
Un laboratorio de Ley de Boyle puede tener diferentes objetivos pedagógicos dependiendo del nivel educativo en el que se aplique. A continuación se presentan algunos ejemplos de objetivos que pueden tener un laboratorio de Ley de Boyle tanto a nivel de colegio como de universidad:
A nivel de colegio:
- Que los estudiantes comprendan la Ley de Boyle y su importancia en la física de los gases.
- Que los estudiantes practiquen habilidades experimentales y de observación.
- Que los estudiantes desarrollen habilidades de análisis y representación de datos.
- Que los estudiantes comprendan la relación entre la temperatura, presión y volumen de los gases.
A nivel universitario:
- Que los estudiantes conozcan la Ley de Boyle y su importancia en la física de los gases.
- Que los estudiantes demuestren habilidades experimentales y de observación en el laboratorio.
- Que los estudiantes apliquen conceptos teóricos de la física de los gases en situaciones prácticas.
- Que los estudiantes desarrollen habilidades de análisis y representación de datos en un contexto científico.
- Que los estudiantes comprendan cómo se relacionan la temperatura, presión y volumen de los gases en diferentes situaciones.
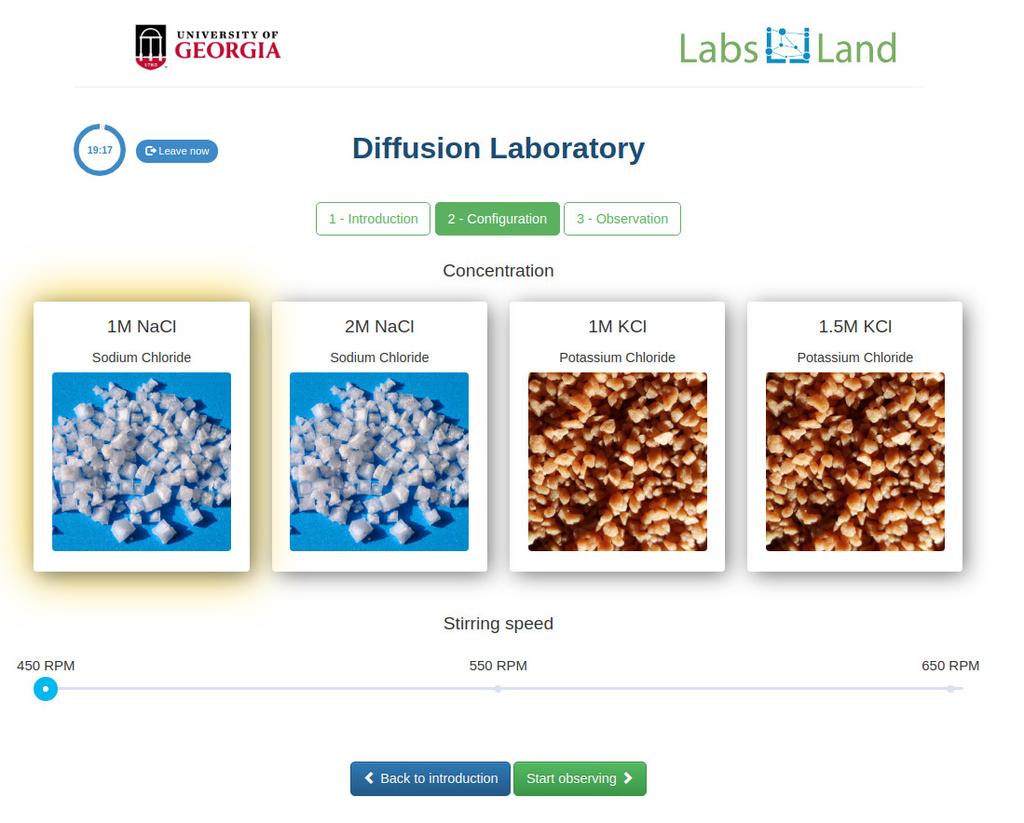
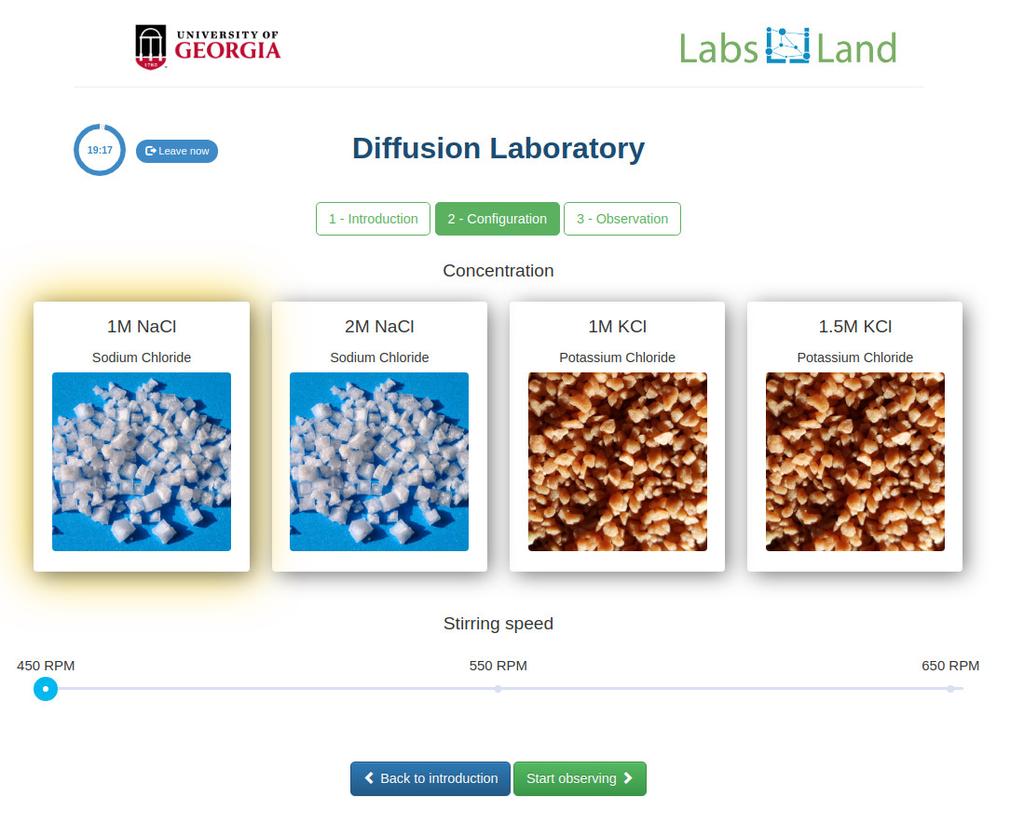
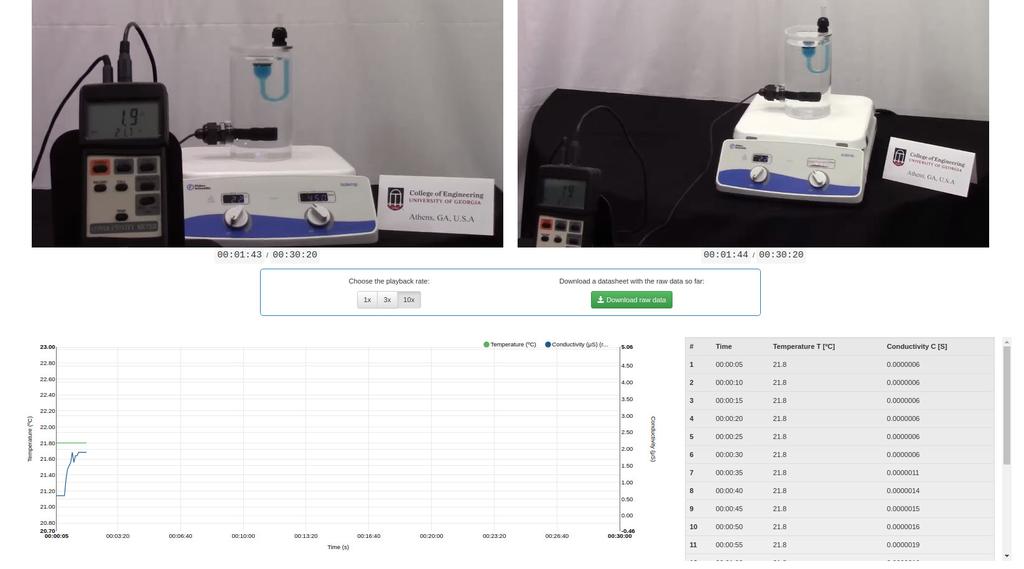
Diffusion laboratory - basic
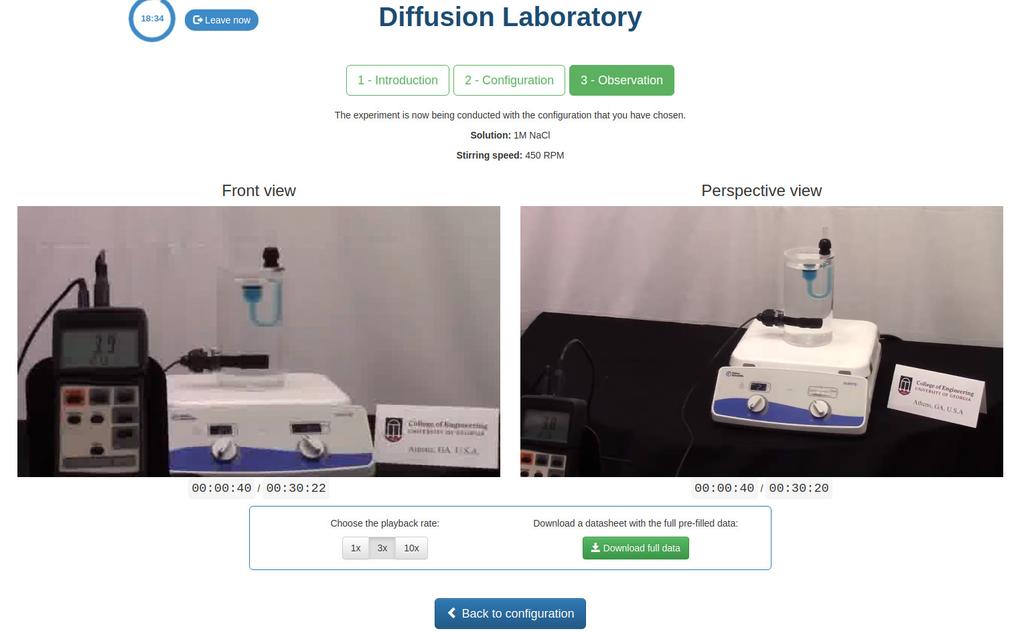
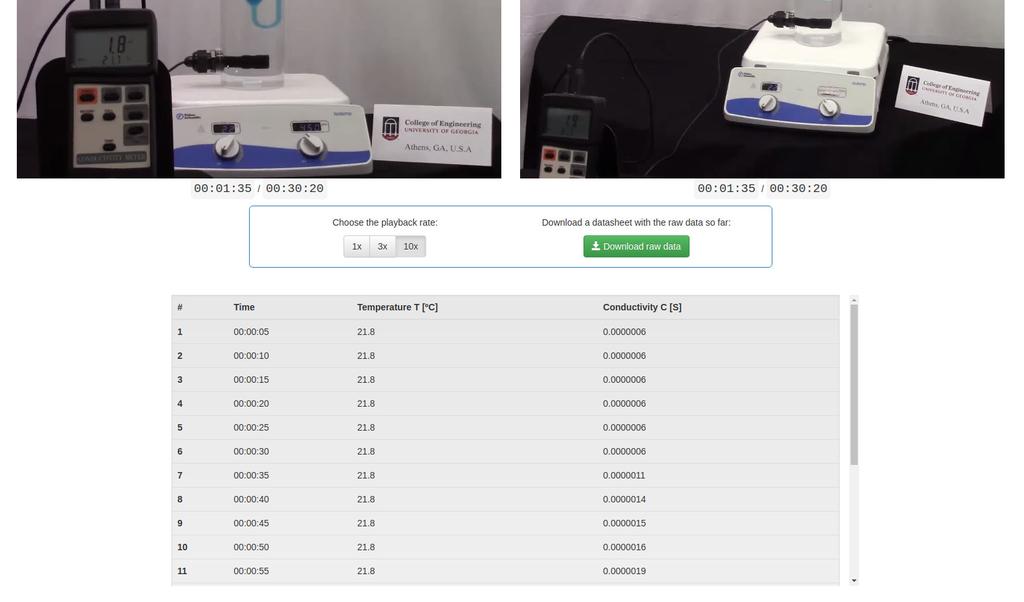
Diffusion laboratory - data
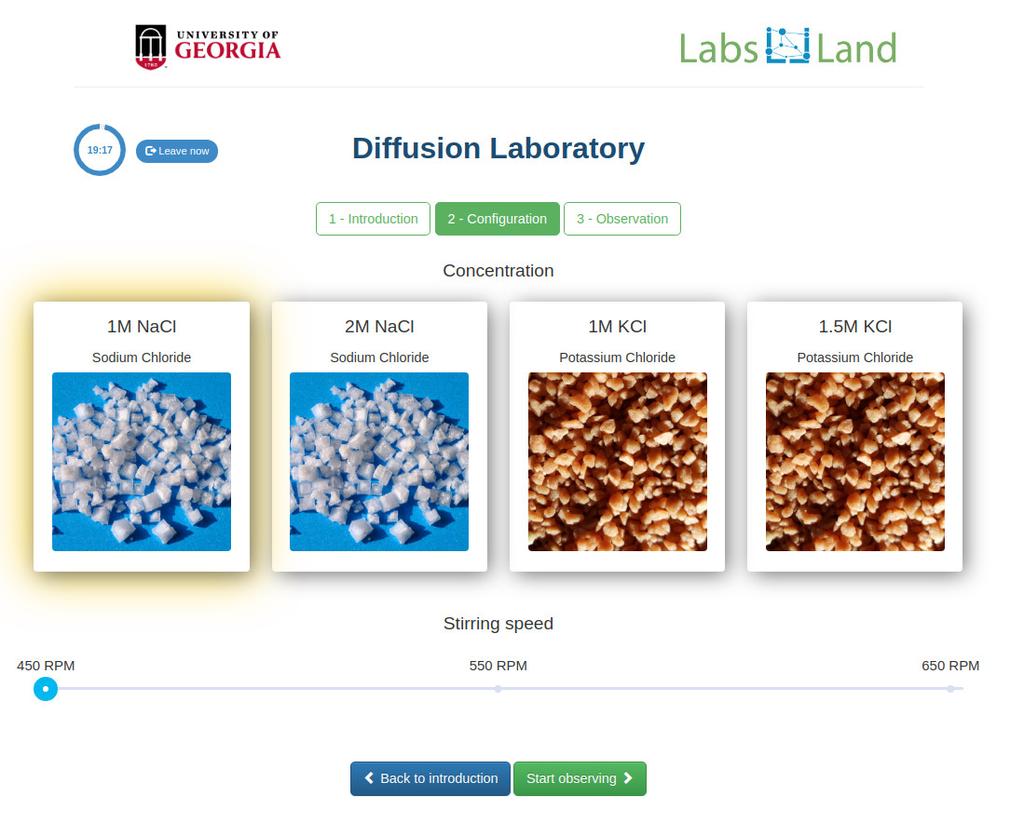
Difusión
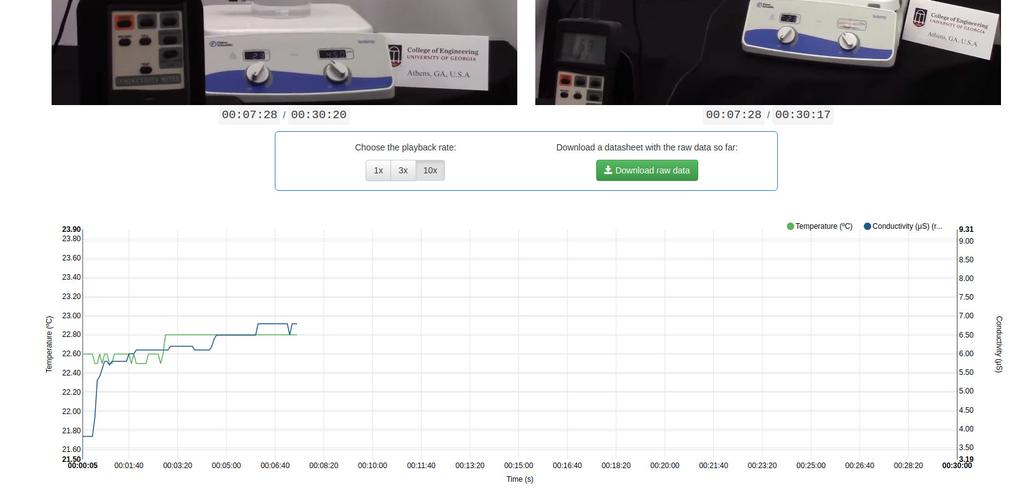
Diffusion laboratory - plot
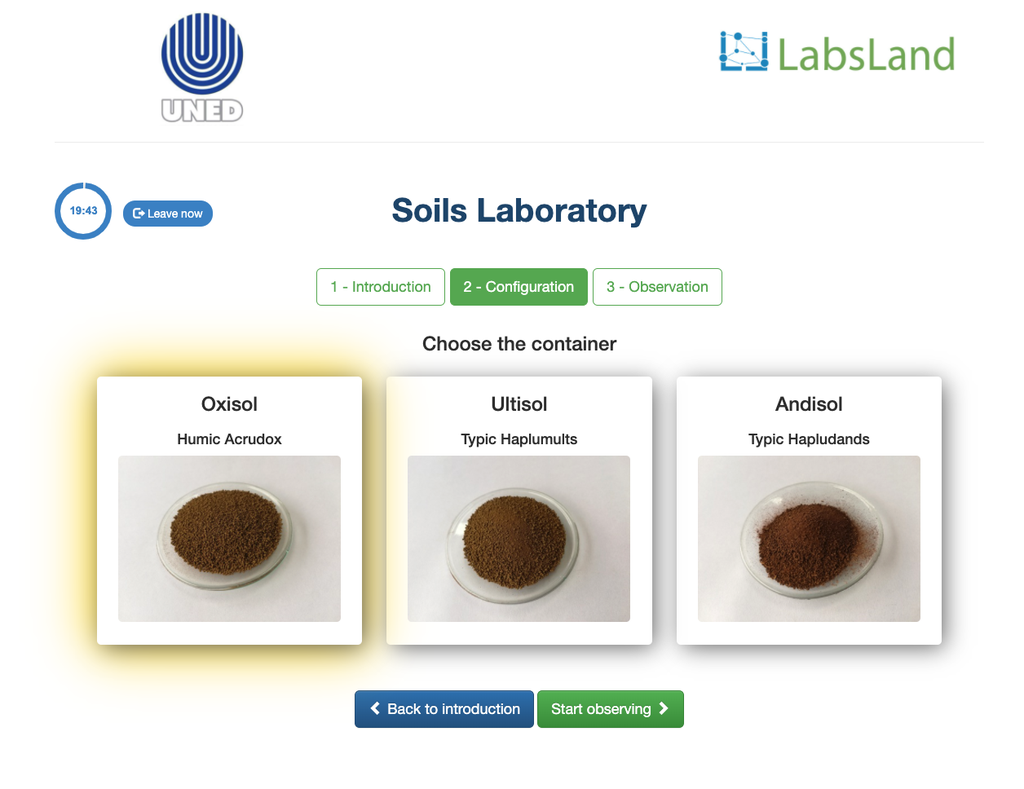
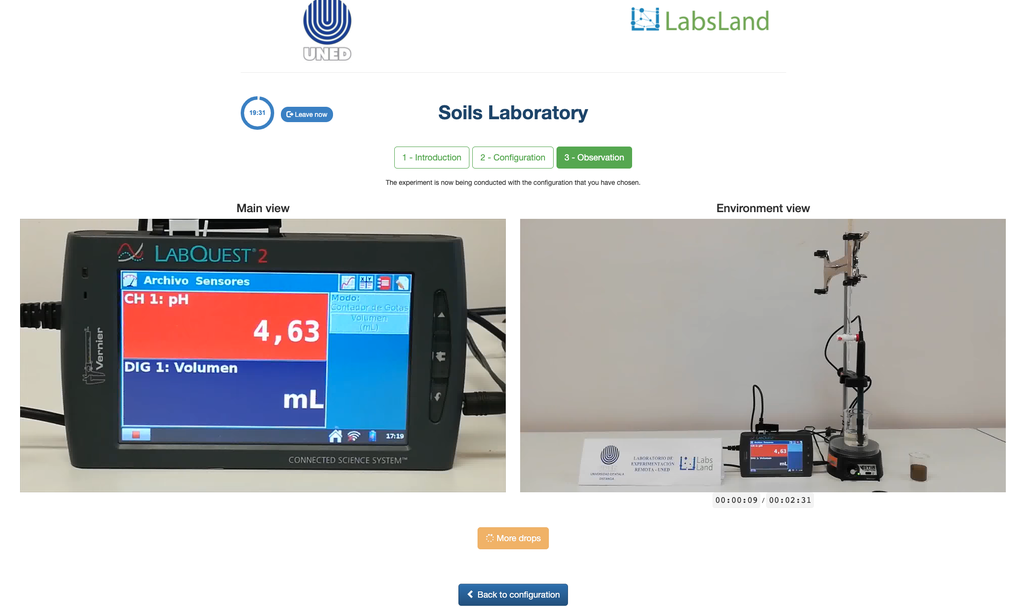
Acidez Intercambiable del Suelo
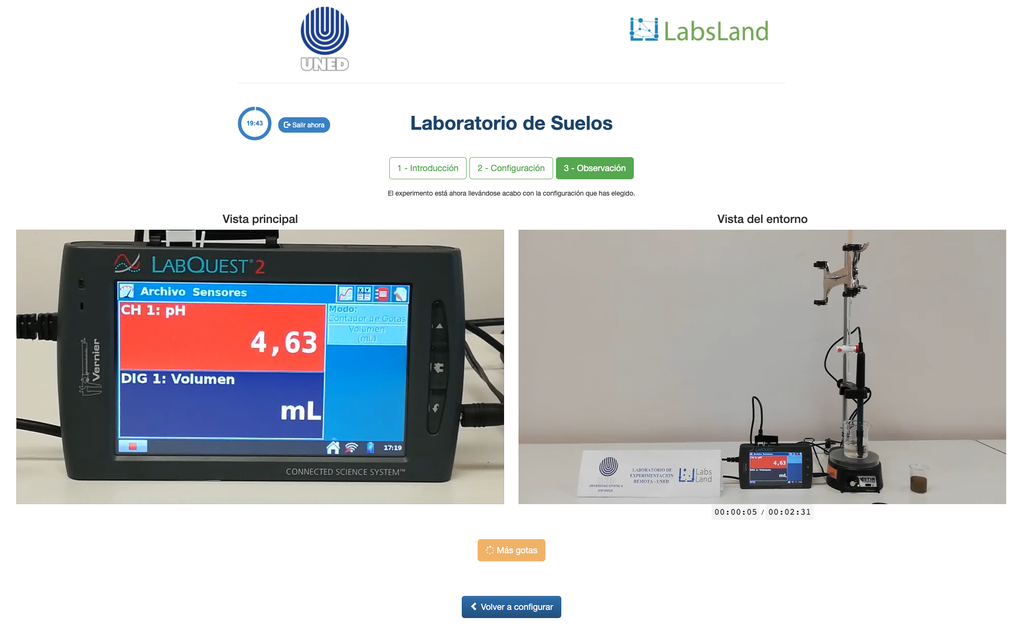
La acidificación del suelo puede ocurrir debido a varios procesos que promueven la disminución del pH. Estos procesos ocurren de forma natural o por acción del ser humano. Las principales fuentes de la acidificación de los suelos están asociadas a los iones hidrógeno (H+) y iones aluminio (Al+3) en la disolución del suelo. La acidez intercambiable se determina con el uso de disoluciones de sales neutras como el cloruro de potasio (KCl). Los iones ácidos (aluminio e hidronio) que se encuentran retenidos en la fracción coloidal del suelo, que en presencia de un ión desplazante (K+), hace es estos ingresen a la disolución de suelo. Posteriormente, se titula dicha disolución con una disolución de hidróxido de sodio de concentración exacta hasta alcanzar el punto final de la reacción de neutralización usando fenolftaleína como indicador.

Ley de Gay-Lussac
La ley de Gay-Lussac es una ley que permite estudiar el comportamiento de los gases y es estudiada habitualmente en física y química. Relaciona la presión del gas con la temperatura, mientras se mantienen constantes otros parámetros como el volumen y la cantidad de sustancia.
Existen diversas maneras de verificar el cumplimiento de la Ley de Gay-Lussac. En este experimento se comprobará que, para una cantidad determinada de gas, la presión es directamente proporcional a la temperatura.
Radiactividad
Comprueba la cantidad de particulas emitidas por difrerentes materiales radioactivos y que son captadas por un contador Geiger real. Modifica la distancia entre la muestra y el contador, así como el tiempo de exposición. También puedes poner un material absorbente entre la muestra y el contador y ver el efecto que tiene sobre las medidas.

Espectroscopía
Este laboratorio diferido se basa en una práctica experimental sobre espectroscopía de rayos X utilizando un aparato marca LEYBOLD que se encuentra instalado en un laboratorio de Instrumentación Radiológica del Edificio de Física Médica Aplicada de la Universidad Nacional de Costa Rica.
El montaje consiste en un tubo de rayos X con ánodo de oro (Au), junto a un detector de centelleo configurado con un preamplificador y una digitalizadora que permiten procesar información de las mediciones que realiza el detector a través de un software.
El ensayo busca caracterizar el haz de la fuente de radiación mediante el cálculo experimental del espectro del haz de rayos X producido en el tubo, además de generar nociones básicas sobre instrumentación radiológica y como la variación de sus parámetros se aprovecha en aplicaciones industriales y médicas.











